近日,一款新的细胞疗法点燃了投资者的热情。
在大洋彼岸,Adaptimmune的TCR-T疗法药物Tecelra获得FDA批准上市,成为全世界*上市的TCR-T药物。在CAR-T还在血液瘤适应症中寻求突破时,该疗法直接被批准了实体瘤适应症——滑膜肉瘤。
而恰巧国内方面也来了新的消息,香雪制药的TCR-T药物TAEST16001注射液被CDE纳入突破性治疗品种名单,大大加快了临床和审批上市的进程。
而今日,又以该疗法的新消息传来:老树东北制药开出了新花——收购了在TCR-T疗法深耕的公司鼎成肽源。
该疗法的备受重视并不是偶然,由于对实体瘤的显著作用,它的适应症空间将要比CAR-T大非常多,未来随着靶点的拓展,它的商业化价值或许将远超现在的估量。
01 TCR-T——另辟蹊径的细胞疗法
TCR-T与CAR-T疗法步骤是看起来是大体相似的。基本思路都是提取患者的血液,在血液中分离和纯化T细胞。然后对T细胞进行在体外进行基因修饰使其能够特异性识别特定抗原,使其成为CAR-T或TCR-T细胞,然后再将成品细胞在体外进行培养扩增,最后注射进入患者体内。
但在疗法机制上,二者有较大差距。概括来说,CAR-T疗法中的T细胞靶向的是谁呢?是血液瘤细胞例如B细胞表面的抗原,最经典的抗原自然是CD19和BCMA。而这也造成了CAR-T的局限性,首先是实体瘤用的靶点基本都不是肿瘤特异性靶点,其在正常细胞上也会适当表达,这对其安全性造成了巨大的挑战,而血液瘤不同,虽然正常B细胞也会被攻击,但只要患者造血功能正常便能及时恢复。此外,就是CAR-T细胞是识别肿瘤细胞表面抗原来杀灭肿瘤的,但实体瘤微环境相当复杂,其内部太多不规则的血管和细胞,大大影响了CAR-T与癌细胞的接触。
而TCR-T疗法具体杀灭肿瘤细胞的过程是如何的呢?核心在于TCR与MHC两个关键概念。组织相容性复合物-多肽综合体(MHC)是细胞表面的蛋白质,它可以呈递细胞内部的蛋白抗原片段到细胞表面。TCR是T细胞表面的特异性受体。其通过识别并结合特定细胞上的MHC呈递的抗原,从而激活T细胞。另外MHC可将细胞内的蛋白分解后的片段呈现在细胞表面,TCR通过与MHC相结合来判断靶细胞是否正常,如果T细胞发现MHC呈现出的蛋白片段是变异的,就会杀死靶细胞。
一般情况下人体内天然的TCR对肿瘤细胞特定抗原的亲和力相对较低,无法大规模识别和杀死肿瘤细胞。而TCR-T疗法设计的核心理念就是改造TCR,使其拥有特异性识别肿瘤细胞的能力,从而有效识别并杀伤肿瘤细胞。
CAR-T和TCR-T二者免疫过程的区别在于是否需要MHC分子的参与。TCR-T必须通过与MHC特别分子的有效相互作用来产生免疫杀灭肿瘤细胞。而MHC分子的优势在于其可以把胞内抗原传递到细胞分子表面,从而不用局限于肿瘤细胞表面的抗原,大大拓展了实体瘤相应的靶点。而CAR-T细胞识别肿瘤表面的特异性抗原不需要MHC处理,这样可以免去一些局限性,但也较大限制了靶点的想象力。

此外,在稳定性和安全性上,TCR-T均体现了相对CAR-T非常好的优越性。CAR-T由于CAR-T细胞的大量扩增,易于引发细胞因子释放综合征,这已经是老生常谈。而在临床试验中,TCR-T的副反应则明显发生率较低。此外,TCR-T的基因改造并不会导入人为改造的基因,免疫原性低,可以使得改造后的TCR-T细胞在人体内存活时间大大延长。
02 先驱者Adaptimmune
在TCR-T领域,Adaptimmune(ADAP)应该是*个举起火把的人。
十年饮冰,难凉热血,这是biotech的常态,也是其创始人应该有的品质。ADAP成立于2008年,2014年入选Fierce15榜单,成为明星biotech之一。次年,其在美股上市,募资1.5亿美元。
值得注意的是,在2019年,ADAP购买了日本Noile-Immune公司的PRIME技术,用于T细胞的增殖诱导和迁移增强。而另一家购买该技术的biotech现在已经名扬四海,它的名字叫传奇生物。
其首发管线就是近期获批上市的FIC——Afami-cel,靶向MAGE-A4,适应症为滑膜肉瘤。
而TCR-T在首先寻求突破的适应症上,往往都会选择软组织肉瘤。在美国每年有13000例新发软组织肿瘤患者,其中5-10%为滑膜肉瘤,五年生存率仅为20%。也有说法,软组织肉瘤的真实发病率被低估,特别是在2001年之前,很大一部分胃肠道间质瘤(GIST)患者可能没有被纳入肿瘤登记数据库。
目前该领域的疗法也较为传统,除了一些化疗药物外,比较经典的药物是帕唑帕尼——一种多蛋白酪氨酸激酶小分子抑制剂,由葛兰史塔克研发,它的FDA获批时间已经要追溯到2009年了。而近年来,由其与PD-1单抗联合用药是比较主流的治疗策略。帕唑帕尼的销售峰值在2014年,为7.32亿美元左右。
这也从侧面折射出这次Afami-cel的获批,对该项适应症具有里程碑式的意义。其加速获批也主要是依赖于SPEARHEAD-1的实验结果。
SPEARHEAD-1是一项单臂、开放标签、2期试验,将16岁以上诊断为晚期滑膜肉瘤或黏液样脂肪肉瘤/黏液样圆细胞脂肪肉瘤的患者纳入试验1队列。患者基线上,必须既往接受过蒽环类药物或含异环磷酰胺方案的治疗。
结果显示,患者的ORR为43%,中位至缓解时间为4.9周,中位DOR为6个月,总生存期上,队列1患者的中位总生存期约为17个月。对afami- cell治疗有反应的患者在治疗后2年有70%的机会存活。
这个数据所弥补的,是目前该适应症后线治疗的稀缺性,目前仍然是上个时代的主流药物在苦苦支撑,前线药物无非是主流的化疗药物,而后线药物目前也只有帕唑帕尼和艾日布林等少数小分子药物可用,只有少数特殊情况才能用K药等抗体药物。如此情况之下,一款优异的后线疗法无疑是该适应症一支强大的生力军。
销售方面,该药的定价比市面上主流的CAR-T疗法还要高出许多,达到了72.7万美金/针。公司预计每年将会有数百例病人接受TECELRA®的治疗,其产品以目前的适应症来看,年销售额峰值可能将达4亿美元。
但笔者认为,该公司的后续管线和适应症拓展,远比这个这个FIC目前的适应症具有想象力空间。
其另一条同时正在开发的管线lete-cel 目前正处于临床II期阶段,靶向NY-ESO-1,其适应症为该靶点阳性的滑膜肉瘤和黏液样圆细胞脂肪肉瘤。根据其临床I期数据,在73例接受Lete-cel治疗的患者中,45例可评价疗效,其ORR率达到了40%,且中位缓解持续时间为10.6个月。对于I期来说,这已经是个不小的样本量,足以代表相对丰富的信息。
这两条管线的并行推进,目的则是对软组织肉瘤进行更加广泛的覆盖。据预测,lete-cel的销售峰值同样可以达到4亿美元。但TCR-T疗法的想象力,还可以得到更大拓展。
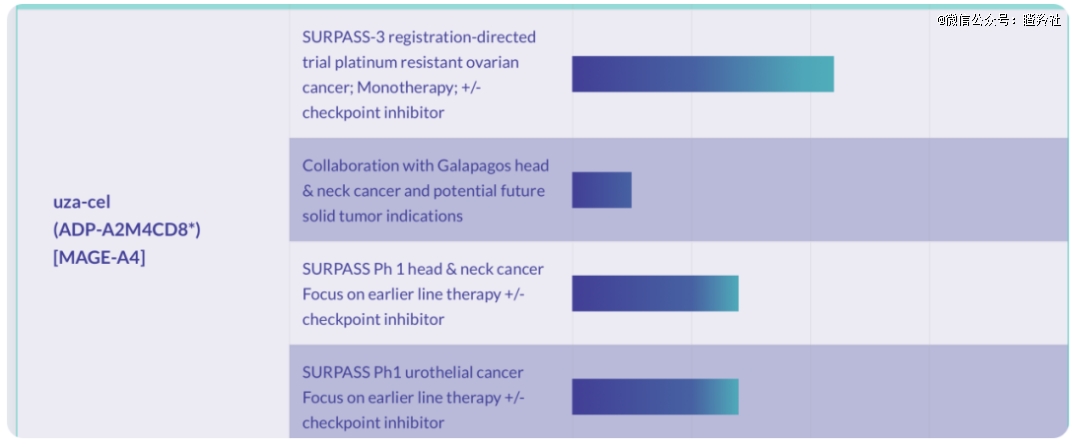
ADAP的第三条管线:uza-cel便着重在拓展适应症。其目前的铂耐药卵巢癌适应症已经进展到了临床II期阶段,而该适应症人群远大于前者。在美国,卵巢癌是妇科肿瘤首位的致死原因,在所有肿瘤中排第五位。根据美国癌症协会(ACS)的估计,2021年美国有超过2.1万例卵巢癌新发病例,超过1.3万人死于卵巢癌。
此外,uza-cel的另外两条早期前线治疗适应症的管线也推进到了临床I期阶段,其中一条管线是尿路上皮癌,另一条是头颈癌。这几个适应症Afami-cel的相对首发适应症而言,人数也得到了数倍的扩增
如果说前几天获批的Afami-cel只是开胃小菜与市场试验品,那么uza-cel才是真正横扫市场的TCR-T疗法的饕餮盛宴。
03 巧合发生——国内同时惊现Breaking News
就在ADAP获批的同时,国内的香雪制药也传来了TCR-T获得突破性进展的消息——TAEST16001被纳入突破性治疗品种名单。
香雪制药这家公司其实在二级市场名气并不大,因为它其实是做中药起家的公司,能够下定决心去跨界拓展如此前沿的疗法,决心令人感叹。
TAEST16001靶向NY-ESO-1,适应症为HLA-A*02:01阳性且表达NY-ESO-1抗原的晚期软组织肉瘤患者。该管线是中国*获得IND批件的TCR-T产品,也是我国*进入II期临床的TCR-T管线。并且其临床进度,比起同靶点的lete-cel丝毫不差。
根据2024年ASCO大会上展出的II期临床数据,该II期临床有其局限性:受试者太少,仅有8名患者。由独立影像评估委员会(IRC)评估的*缓解率为50%(4/8)。由IRC和研究者评估的中位无进展生存期(mPFS)均为5.9个月。目前仍在随访状态。
这不是其*次亮相该ASCO,事实上,其I期临床结果已经亮相过2022年ASCO。根据其I期临床数据,肿瘤客观缓解率(ORR)达到41.7%,与let-cel的数据相当。而I期研究结果也刊登在了IF约为17的期刊:《Cell Reports Medicine》上。
但该药的商业价值的催化真的值得目前香雪制药连续好几天20%的涨幅吗?目前来看值得商榷。因为目前let-cel与其具有非常相似的数据和进度,可比性较高,目前let-cel的销售峰值预估为4亿美元,并且美国的定价普遍比中国高,其定价可以达到70亿美元以上。按照CAR-T的定价来看,美国的定价换算成人民币大约是中国定价的2.5-3倍左右,按照三倍来计算,该药在中国的定价大约为170万元。但中国的总人数比美国高,但中国肯定无法医保报销,且人均收入不如美国的情况下,如果按照治疗人数1.5倍来进行估算,那么该药的销售峰值大约为14-15亿元。
但如果再考虑CAR-T疗法在中国销售上不及预期的情况,目前中国市场对该药物的接受程度并不乐观。以药明巨诺的CAR-T贝诺达为例,它2021年9月上市,第二个完整年度的2023年开出的处方184张,整个公司营收仅仅1.74亿元。因此,TCR-T真正的销售峰值还需要继续再向下调低预期。
事实上,该药获批突破性疗法确实应该获得一定股价催化,但目前该公司也有一定的不利因素,最近三年累计亏损16亿元,2020年之前都处于盈利状态,2020年归母净利润为7200万元。所幸目前亏损正在同比缩窄,2023年亏损仅为2021年一半左右。
此外,目前该公司的现金储备也值得商榷,目前2023年其现金储备仅剩1.5亿左右,而在2020年其现金储备为6.1亿元。其负债率也处于逐步上升的趋势,从2020年9月底的57.07%到了2023年9月底的70.79%。
从这里也可以看到该公司All in TCR-T疗法的决心,就看其能否依靠自己独立跑出,熬到商业化放量夜尽天明的那天。
而今天,由于TCR-T居高不下的热度,东北制药也迎来了股价的大涨,原因是收购鼎成肽源而被投资者们发现且炒作,也从侧面印证了投资者对该药物的关注度。但收购如此前沿的疗法是一体两面的事情,同时也面临着风险。
鼎成肽源目前还没有TCR-T产品进入临床阶段,属于较为早期的biotech,其进展最快的DCTY1102目前走到IND申报阶段。不过它的靶点很有意思,为KRAS G12D,该靶点主要针对的适应症是胰腺癌和肠癌,。KRAS基因是人类癌症中最常见的突变癌基因之一,其突变频率在胰腺癌中为35%、结直肠癌为13%和非小细胞肺癌4%。

该靶点从前成药性较为困难,近期终于取得了突破。而走的最快的,是医药一哥恒瑞的HRS-4642。根据其在ESMO2023年会上公布的I期临床阶段性报告,已入组的18例受试者中(肺腺癌n=10,结直肠癌n=5,阑尾粘液腺癌、卵巢癌和胰腺癌各1例),1例达到部分缓解(PR),疾病控制率(DCR)77.8%,53.8%的受试者靶病灶缩小。其中10例NSCLC患者中,1例达到PR,DCR高达90.0%,62.5%的患者靶病灶缩小。数据相当可观。
这可能也体现了老牌药企在收购优质项目上独到的眼光,DCTY1102在未来的TCR-T疗法的适应症拓展上,将起到的作用不可估量。但前沿疗法的背后,也存在有一定“赌”的成分,目前KRAS G12D这个靶点的TCR-T疗法大多只存在于学术文献的个例之中,真正商业化能不能成功,带有极大的不确定性。而东北制药在这点与香雪有相同之处,都在下一代疗法上愿意去冒风险,完成自身向创新药研发企业的转型。
结语:TCR-T疗法在近期频出热点,背后折射出的投资者们对细胞疗法由血液瘤到实体瘤拓展的期待,而如今这个期待距离变成现实,已经不再遥远。