10月23日,罗氏发布公告,宣布已与Roivant Holdings达成最终协议,将收购Roivant子公司Telavant及其药物管线RVT-3101。根据协议条款,罗氏将预付71亿美元的收购价格和1.5亿美元的近期里程碑付款。交易完成后,罗氏将获得在美国和日本开发、生产和商业化RVT-3101抗体的权利。
此外,交易完成后,罗氏还将选择与辉瑞就下一代p40/TL1A定向双特异性抗体进行全球合作,目前处于*阶段。
3个月前,Roivant Sciences或向罗氏出售其重磅溃疡性结肠炎(IBD)候选治疗药物RVT-3101将超70亿美元的消息尘嚣日上。直至今天,重磅BD交易终于尘埃落地,与当日传出的交易金额大致相当。而这单交易之所以引入注目,不单是高达71亿美元的交易金额,也是最强“捡漏王”Roivant 再次更新动态,甚至还牵涉到“宇宙大药厂”辉瑞的战略选择。
辉瑞“弃子”RVT-3101
本次交易涉及到的关键药物RVT-3101,是辉瑞去年底踢掉的“弃子”。
RVT-3101是辉瑞的原研药。2022年12月,辉瑞宣布与Roivant合资成立Vant公司,RVT-3101顺利落入Roivant口袋。根据双方协议,RVT-3101后续的开发将由Roivant/Vant全权负责,Vant将获得该药在美国和日本的商业权利。辉瑞持有 Vant 25%的股权,拥有美国和日本以外的商业权利,并在公司董事会中拥有代表权。
公开资料显示,RVT-3101是一种靶向TL1A的全人源单克隆抗体,通过抑制TL1A靶向炎症和纤维化途径,是一种潜在的first-in-class的药物。目前,RVT-3101已在TUSCANY-2期2b研究中对中度至重度溃疡性结肠炎患者进行了研究。245名UC患者试验的试验数据显示,接受RVT-3101*剂量的受试者经过56周的治疗后中有36%实现了临床缓解,高于第14周的29%;第56周有50%的*剂量受试者显示内镜改善,高于第14周的 36%;第56周有21%的*剂量受试者表现出内镜缓解,高于第14周的11%。在安全性方面,所有剂量下在56周内都有良好的耐受性。
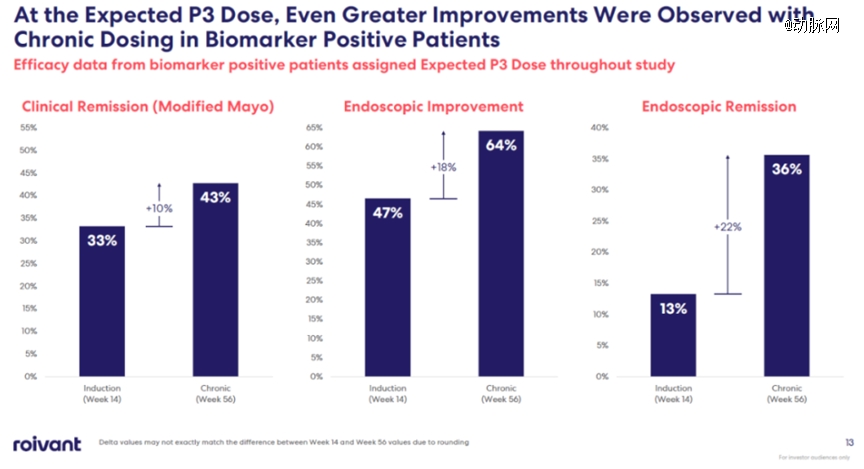
▲图源:Telavant官网
据Roivant的网站显示,RVT-3101同时在进行用于克罗恩病的2期临床试验。协议完成后,罗氏将致力于尽快启动RVT-3101的全球3期试验,用于治疗溃疡性结肠炎(IBD)。另外,在美国和日本以外,由辉瑞掌握商业化权利。
曾有SVB的证券分析师在辉瑞宣布与Roivant合资成立Vant公司时表示,Roivant斩获RVT-3101可能代表有望在美国获取近150亿美元的商业机会。
最强“捡漏王”Roivant
今年7月发布的一份报告中,花旗分析师称RVT-3101是“高度抵押资产”,因为辉瑞的合作伙伴关系,估计Roivant在Telavant的股份价值约为45亿美元。
Roivant由Vivek Ramaswamy于2014年创建。成立至今,Roivant孵化了21家子公司,其中4家已成功上市,5家则在2019年便被日本住友制药以30亿美元收购,2022年住友制药又追加17亿美元收购Roivant子公司剩余股份。同时,9年时间Roivant共计6款药物获得了FDA批准上市。
由于Roivant创建的所有公司名后缀均为“vant”,打造出了自己的“Vant帝国”。Roivant 旗下各biotech都作为一个独立的实体运营,以保留初创公司的敏捷灵活性和创新创业精神,同时,各biotech都可以共享来自Roivant和由其他数据驱动的其他biotech的资源来支持相关药物的开发及商业化。
谈到“捡漏”,Vivek Ramaswamy在做投资人时发现许多大型制药公司会因为各种原因放弃在研药物,这些“失败药物”本身其实有着广阔的前景,“为什么不接盘大公司放弃的药物继续研发呢?”
自2014年成立后,Roivant公司便开始“捡漏”失败药物。比如,2015年,Roivant从GSK手中以500万美元预付款获得的阿尔茨海默病药物Intepirdine(RVT-101),一度为Ramaswamy带来了超过20000%的账面回报率,使得Axovant上市首日,市值逼近30亿美元。
2016年,Roivant的子公司Myovant与武田达成协议,获得了Relugolix的全球开发和销售权。在这笔交易中Myovant做到了零首付,仅付出了510万股公司股份,以及低于10%的销售提成。4年后,Relugolix成功获得FDA批准上市。去年,Relugolix在美国和中国市场合计收入1.82亿美元。
此外,Roivant在资本市场也有不菲的表现,先后斩获软银、韩国SK控股、RTW Investments等多家机构的投资,其子公司Axovant和Myovant分别创下2015年和2016年美国市场上规模*的生物医药IPO记录。
“黑马”靶点TL1A
作为一种不易根治的慢性病,炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD)。在北美和欧洲,分别有超过150万人和200万人受其困扰。广泛的市场带来了强劲收入的可能性,据华创证券数据,仅在美国,针对IBD的先进疗法就有年近150亿美元的商业市场,并且规模还在持续增长。
IBD领域存在诸多重磅产品的身影,向来也受MNC青睐。由于经典抗TNF生物制剂的缓解率和持久性局限,科学家们持续探索新的靶点与疗法——有证据表明,抗TL1A(TNF配体相关分子1A)抗体或有可能成为IBD市场的下一个“爆点”。
TL1A属于TNF超家族成员,能独立介导炎症和纤维化,与RA、特应性皮炎、SLE、哮喘、银屑病等免疫和纤维化疾病有关,TL1A阻断机制在炎症和纤维疾病中有广泛的应用潜力,目前临床已验证能用于治疗IBD。
尽管TL1A尚未经过市场的检验,但仍有不少药企重磅押注——2023年6月,默沙东以108亿美元淘汰掉竞争选手艾伯维和BMS成功收购Prometheus,获得TL1A单抗PRA-023;2023年10月,赛诺菲与梯瓦制药达成合作,以5亿美元预付款和高达10亿美元的开发和里程碑付款,共同开发的新型抗TL1A疗法TEV'574。
国内来看,据荃信生物招股书数据,中国IBD患者不及美国,2017年为44.93万人,2021年增至62.63万人,预计2030年患者将达120万人;药物市场规模略增长,由2017年的4.80亿美元增至2021年的8.85亿美元。作为一种典型的工业化疾病,发展中国家患病率正在向发达国家接近。