在每一个产业的进化历程中,技术路线决定命运的相似脚本总在不断重演:
一种技术路线负责揭竿而起并发出*声咆哮,而另一种技术路线则姗姗来迟。但后来者往往能够凌空而起,后发先至。
在小核酸药物的研发之路上,RNAi与ASO的发展就是这样的例子。
ASO疗法率先出现,并早早证明了成药性。而RNAi疗法,发展历程一路坎坷,在ASO药物成药二十年后,才证明自己。
不过,进度上的落后,并没有影响RNAi的发展。2018年,随着*RNAi药物成功上市,RNAi疗法开始逐步崛起。
虽然两者不是完全替代关系,但ASO的部分领地依然被RNAi分食。更重要的是,ASO与RNAi之间的差距似乎逐步显现。
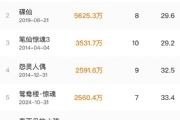
2021年时,RNAi与ASO各自领域的头号玩家Alnylam与Ionis,营收都在8亿美元左右。但到了2022年,Alnylam产品净收入就达到了8.94亿美元,Ionis营收则下滑到了5.87亿美元。
市值或许更能说明一切。如今Alnylam的市值236亿美元,而Ionis仅为58亿美元,相差4倍。这也预示着,市场更憧憬RNAi疗法的未来。
01、小核酸领域的后来者
一项技术只有从实验室走向临床,其社会、商业化价值才能*化。然而从实验室走向临床,注定会是一路艰苦卓绝。哪怕是有诺奖加身的RNAi疗法也不例外。
将时间拉回到1998年。彼时,小核酸药物分支之一的ASO(反义寡核苷酸)药物,已经带来了*款ASO药物Vitravene。
而另一种小核酸药物RNAi的作用机制才刚刚被发现。当时,来自美国的两位科学家将双链RNA导入线虫基因中,并发现双链RNA较单链RNA更能高效地特异性阻断相应基因的表达,他们称这种现象为RNA干扰(RNAi)。
说得简单点,就是双链RNA破坏了原本的基因表达过程,导致些基因表达被阻断。
顺着这个机制,科研人员想到,如果将RNAi用在药物研发上,RNAi药物递送入细胞内部后,能让任何致病基因“闭嘴”,不能表达出蛋白质,自然也就没法继续发挥任何致病功能。那么很多疾病就可以被简单粗暴的解决了。
2004年,*RNAi药物Bevasiranib进入临床,RNAi药物开始走上舞台。故事的高潮发生在2006年,这一年发现RNAi的两位教授获得了诺贝尔奖。
伴随着这一最高荣誉的加身,RNAi步入了黄金时代,大药企、风投机构如潮水般涌向RNAi的公司。与此同时,发展较早的ASO药物瞬间感受到了众叛亲离的滋味。
然而,热潮来得快去得也快。追捧者们很快发现,RNAi疗法并不成熟,面临稳定性差、递送效率低、安全性差等问题。
其中,最为致命的是递送问题,双链RNA一旦送入体内,会被血液中的酶会迅速破坏,无法顺利递送至靶组织细胞发挥作用。这一问题,阻挠了RNAi疗法的研发之路。
2009年,*批进入临床III期试验的RNAi疗法Bevasiranib,因早期临床结果不佳终止了临床试验。到了2010年,罗氏、辉瑞和默沙东等制药巨头相继退出RNAi药物的研发,RNAi疗法走入了“至暗时代”。
但仍然一些小药企在这一领域坚持,比如Alnylam、Arrowhead。在他们坚持不懈的努力下,LNP、GalNAc、PNP等递送技术平台的逐步成熟,曾经RNAi药物发展的阻碍,也在逐渐消失。
2018年,*RNAi疗法Patisiran获批上市,由Alnylam公司研发。RNAi药物也由此重新获得市场的关注。
02、RNAi的全面狙击
如今,RNAi药物不仅成功了,并且以一种胜利者的姿态回到小核酸药物战场。尤其是在TTR靶点上,RNAi打了极其漂亮的一仗。
TTR是一种由肝脏主导合成的甲状腺素转运蛋白,正常情况下会形成同源四聚体结构。
而当控制这一蛋白的基因发生突变后,这种蛋白就会错误的形成淀粉样蛋白,并沉积在周围神经系统、心脏、眼睛等所组织和器官中,进而造成难以治疗的hATTR(遗传性转甲状腺素蛋白淀粉样变性神经病)。
全世界,估计有5万名hATTR患者。糟糕的是,此前这种病一直没有治疗方法,患者通常在诊断五年内死亡。
直到2018年10月6日,Ionis研发的ASO药物Tegsedi获FDA批准上市,成为全球*治疗hATTR的药物。
不过,Tegsedi带有黑框警告副作用问题,所以销售情况不算乐观。2022年,Tegsedi和另一款ASO药物Waylivra,合计销售额仅3000万美元。
事后来看,救世主是RNAi药物。在hATTR领域RNAi药物展示较好安全性的同时,治疗效果也更好。
根据III期临床数据,在疗效方面,patisiran与Tegsedi相比更胜一筹,且还能够显著改善心肌病。在安全性上,Patisiran并没有遇到困扰RNA药物的安全性问题。
2018年8月,RNAi药物patisiran获得FDA批准上市,用于治疗hATTR。2022年,patisiran年销售额已达5.58亿美元。
除此之外,在PCKS9这一靶点上,RNAi也开始后来居上。
2014年,Alnylam将靶向PCKS9的RNAi药物Inclisiran推入临床。这一药物能够特异性结合PCSK9蛋白的mRNA前体,导致其降解从而抑制PCSK9的表达,使得血浆LDL-C(低密度脂蛋白)浓度降低。
Inclisiran*的优势在于给药频率,此前他汀类药物需要每天服用,PCSK9单抗需要间隔2-6周注射,而Inclisiran每年仅需两针。
2020年Inclisiran获批上市。鉴于依从性上的优势,2022年Inclisiran收入大涨833%,全年营收达1.12亿美元。
相比之下,靶向PCSK9的ASO药物AZD8233处境相当尴尬。尽管在2022年,阿斯利康/Ionis研发的AZD8233在IIb期临床试验中达到了主要终点,但阿斯利康仍然表示将放弃AZD8233的研发。
促使阿斯利康放弃的原因,或许在于即便AZD8233成功上市,其商业化之路也不会太容易。
与Inclisiran相比,AZD8233需要每月给药,在依从性上并没有更好的表现。
此外,在ATTR、ANG3等多个靶点上,曾经落后的RNAi药物,都开启了弯道超车之旅。
03、有待开启的更大市场
RNAi一次次的弯道超车不令人意外,这是由RNAi疗法路线优势带来的差异结果。
与ASO疗法相比,RNAi疗法有种种优势。
比如,作用时间更持久。由于ASO药物会直接进入肝细胞,只在细胞质中积累,所以需要频繁给药。而RNAi进入细胞后,会在细胞核内不断积累,所以能保持比较长的药物半衰期
再比如,作用效率更高。单个RNAi可以多次介导mRNA的沉默作用,因此其在正确的触发条件下,能够实现较高的治疗效率。
当然了,这并不意味着ASO疗法就毫无用武之地。ASO药物既能够利用碱基配对,又能够通过酶的降解下调蛋白表达,理论上它能够覆盖更多的疾病种类,具有更加广泛的临床应用范围。
更何况,如今的RNAi疗法还面临着一个棘手的难题,如何打破适应症的限制。
目前获批上市的RNAi药物,适应症主要集中在肝脏疾病、罕见病领域。而这是由于RNAi递送技术决定的。
在RNAi领域常用的递送技术是Alnylam开发的GalNAc。这种技术能将N-乙酰半乳糖胺与siRNA连接。肝细胞表面的受体可识别N-乙酰半乳糖胺,从而高度特异性地进入肝细胞,同时限制脱靶效应。
这一递送系统,基本解决了早期RNAi药物研发中遇到的靶向性差、脱靶效应严重和稳定性差等问题。如今Alnylam开发的不少RNAi药物,也都使用了这一递送技术。
但这一递送技术的问题在于,无法靶向肝脏以外的仅有的以肝实质细胞为靶点的GalNAc偶联技术,这限制了RNAi疗法的用武之地,局限于罕见病与肝脏疾病。
而RNAi疗法想要获得更大的发展空间,必然要走到更广阔的市场中,比如在肿瘤治疗、常见病治疗。
所以,眼下摆在RNAi面前的*问题是,需要找到与GalNAc类似的递送方法,让RNAi疗法能够在其他领域发挥作用。
事实上,已有药企在尝试拓展RNAi的作用领域。在肿瘤治疗领域,Arrowhead正在研发治疗透明细胞肾细胞癌的药物ARO-HIF2、圣诺医药正在研发成人原位鳞状细胞皮肤癌的药物STP705。
如此看来,RNAi的故事才刚刚开始。