

近日,备受关注的HER3 ADC接连遭遇挫折:先是宜联生物/BioNTech的YL202/BNT326一期临床被FDA要求暂停,接着默沙东/*三共的HER3-DXd(U3-1402)因第三方生产设施问题被FDA延迟批准上市。
不过,FDA并未对HER3-DXd的有效性和安全性提出异议,意味着整改好生产问题后,HER3-DXd仍将有望成为全球*HER3 ADC药物。
尽管新型ADC药物在临床试验中不时遭遇挫折,但以HER3为代表的广谱抗癌靶点,仍具备巨大的市场潜力。
01 HER3靶点的双刃剑属性
HER3与HER2属于同一家族,其中HER2是知名的广谱抗癌靶点,诞生了多款重磅炸弹药物,包括靶向HER2的曲妥珠单抗、*三共的HER2 ADC药物Enhertu(DS-8201)。
但由于HER2 ADC市场竞争激烈,全球药企都在寻求其他广谱抗癌靶点,*是与明星靶点同类或功能近似。HER3自然成为热门布局方向。
然而,HER3靶点却具备双刃剑属性。
HER3是潜在广谱抗癌靶点,在肺癌、乳腺癌、结直肠癌等多种实体瘤中高表达,且与疾病进展、预后不良以及对EGFR、HER2靶向治疗的耐药性密切相关。
由此,HER3 ADC频频发生重磅BD交易:2023年10月,BioNTech斥资超10亿美元与宜联生物合作开发新一代的HER3 ADC药物,默沙东则与*三共达成220亿美元的全球合作,共同开发HER3-DXd等3款ADC新药。同年12月,百利天恒就EGFR/HER3双抗ADC药物BL-B01D1与BMS达成最高84亿美元的合作,并创下了国产创新药海外授权新纪录。
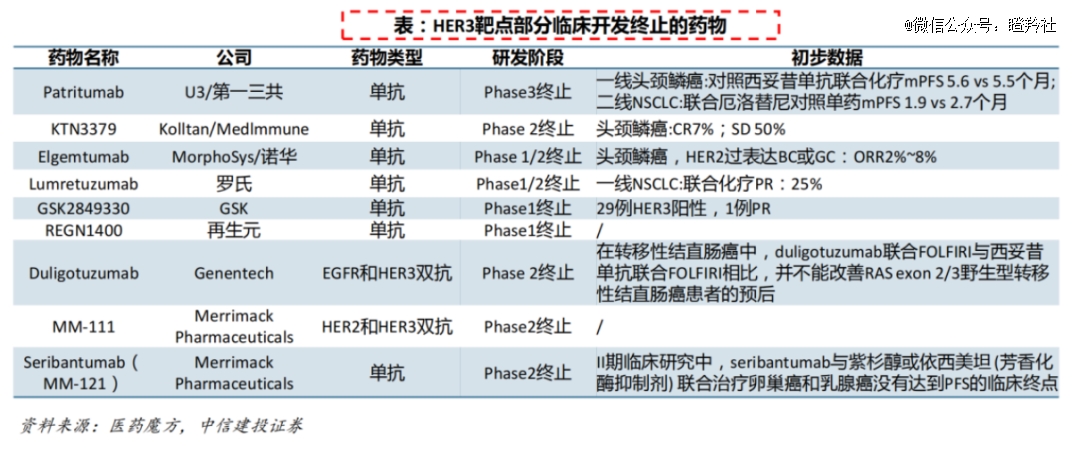
可BD大热的背后,却是HER3靶向疗法研发的困难重重。在过去30多年里,无论是靶向HER3的单抗还是双抗,都未能成药。
例如,*三共的Patritumab、KTN3379、Elgemtumab和Lumretuzumab等HER3单抗,皆因疗效不佳或安全性问题被终止研究;EGFR/HER3双抗Duligotuzumab、HER2/HER3双抗MM-111的临床开发也未能成功。
归其原因,在于HER3几乎不具有胞内酪氨酸激酶活性,且激酶活性非常弱,使得直接针对HER3的单抗或双抗在疗效上受到限制。再加上,HER3与配体的结合力相对较低,增加了药物设计的难度,从而导致临床试验失败率高。
不过,HER3无法成药的历史,或将被具有独特作用机制的ADC药物改写。
ADC药物由抗体、连接子和细胞毒素三部分组成,其独特之处在于:通过其抗体部分特异性地结合HER3,但并不完全依赖于HER3的激酶活性来发挥作用,而且有效载荷(毒素)的释放和细胞毒作用也不需要依赖HER3,就能发挥有效的抗肿瘤作用、引发旁观者效应。
另外,HER3相比HER2和HER1(EGFR)具有更快的内化速度,更有利于ADC药物在肿瘤细胞内发挥药效,提高治疗效果。
02 HER3 ADC的挑战
随着HER3 ADC药物在实体瘤的治疗潜力得到证实,不少药企纷纷布局。
据中信建投研报披露,截至今年3月14日,国内共有17款HER3为靶点的ADC药物,其中5款已进入临床阶段,包括恒瑞医药SHR-A2009、信达生物IBI133和百利天恒BL-B01D1(EGFR/HER3双抗ADC)等。
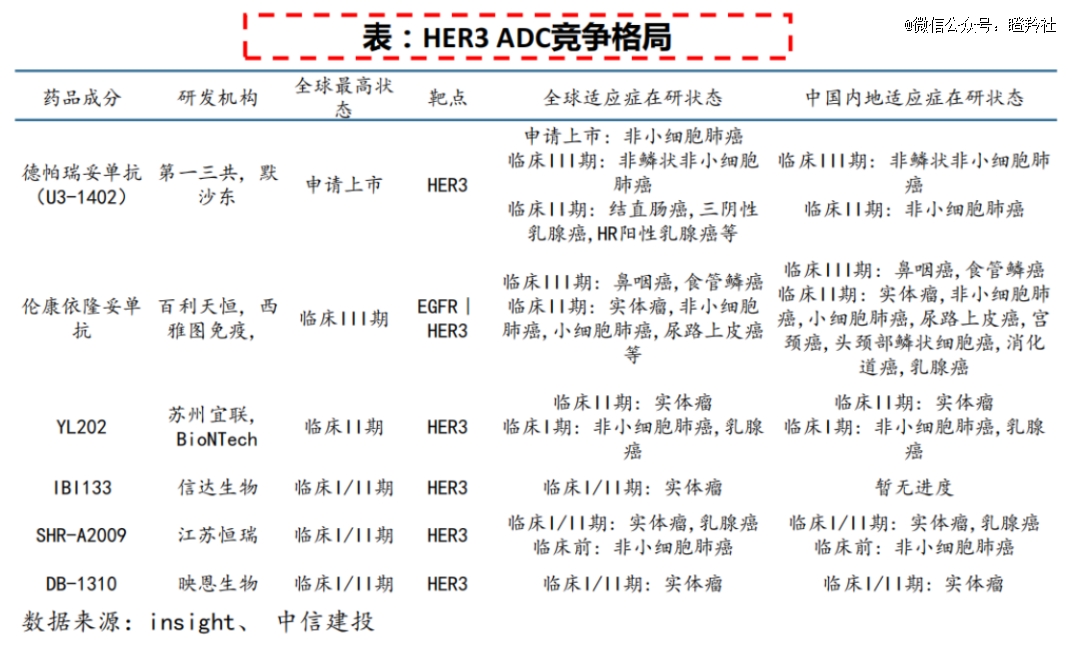
全球进度最快的是*三共/默沙东的Patritumab deruxtecan(HER3-DXd,U3-1402),尽管因生产问题被FDA延迟批准上市,仍有望拿下全球*HER3 ADC药物。
作为*三共继DS-8201、Dato-DXd(DS-1062)后推出的第3款潜在重磅药物,HER3-DXd的治疗潜力备受关注。
HER3-DXd的抗体部分为HER3单抗Patritumab,载荷与DS-8201相同,都是拓扑异构酶Ⅰ抑制剂(deruxtecan),并通过经典的马来酰亚胺-GGFG接头连接组成,DAR值为8。
HER3-DXd的上市申请是基于关键II期临床试验HERTHENA-Lung01的研究结果:在225例接受HER3-DXd(5.6 mg/kg)治疗的EGFR-TKI和铂类化疗后进展的EGFR突变局部晚期或转移性NSCLC患者中,ORR为29.8%,中位PFS为5.5个月,中位OS为11.9个月。
另外,HER3-DXd针对3代EGFR-TKI治疗后耐药的患者也有相似的临床结果:ORR为29.2%,中位PFS、中位OS分别为5.5个月、11.9个月。第三代EGFR-TKI奥希替尼耐药市场广阔,是MNC巨头必争的大金矿,这也是默沙东重金押注的重要原因。
安全性方面,4级以上TEAE发生率为28.9%,主要为血液相关不良事件,极少数患者发生间质性肺病(ILD),总体安全性可控,仅有7.1%治疗中出现的不良事件TEAE导致终止治疗。
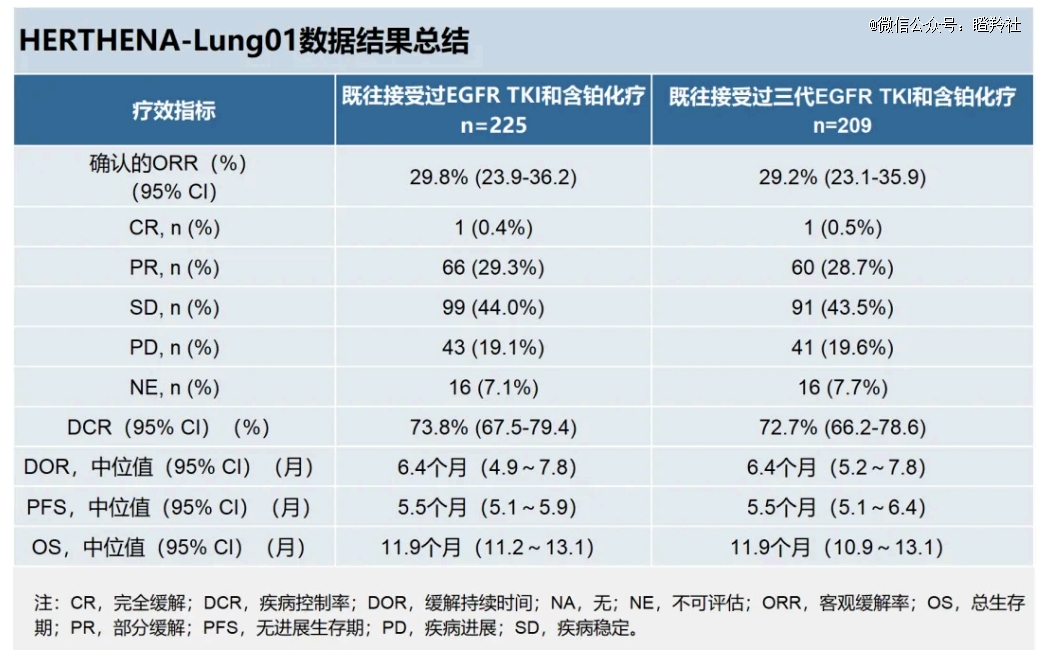
HER3-DXd关键性II期研究HERTHENA-Lung01结果
(图源:Biotech前瞻)
不过,虽然FDA未对HER3-DXd的有效性和安全性提出异议,但安全性仍有待提高。这也是HER3 ADC药物的研发挑战。
此次FDA之所以会要求BioNTech/宜联生物暂停YL202/BNT326的Ⅰ期试验,主要是担忧:在较高剂量下,可能会使人类受试者面临不合理和重大的疾病或伤害风险。
根据宜联生物在2024 ASCO会议上公布的I期临床数据,截至今年4月16日,共入组55人(非小细胞肺癌40人,乳腺癌15人),结果显示:全部剂量下共51例可评估病例,ORR为42.3%,DCR为94.2%,mPFS为6个月,mDOR为5.8个月;其中3.0mg/kg剂量组ORR为60%,DCR为100%。
尽管YL202有望展现出BIC潜质,但在安全性方面:5.5mg/kg剂量组出现一例DLT事件(三级粒缺伴发热),4.0mg/kg和5.5mg/kg剂量组分别出现2例(中性粒和血细胞减少)和1例受试者死亡(新冠感染后间质性肺炎)。
基于此数据,BioNTech/宜联生物后续或许将重点开发4.0mg/kg以下剂量的临床试验。
03 新型ADC药物:机会与风险并存
尽管HER3 ADC药物仍有待改进,但相比频繁折戟的单抗和双抗,已经取得突破性进展。
当前,围绕HER3靶点的国产ADC药物正在摩拳擦掌,包括恒瑞医药SHR-A2009、信达生物IBI133、映恩生物DB-1310,以及涉及HER3靶点的双抗药物,包括百利天恒BL-B01D1(EGFR/HER3双抗ADC)、康宁杰瑞JSKN016(HER3/TROP2双抗ADC)。
其中,已有一些药物公布了积极的临床数据。据I期研究结果显示,SHR-A2009针对NSCLC患者的ORR为30%,DCR为76.7%,中位DoR为7个月(94.4%EGFR突变;80.6%患者对3代EGFR-TKI耐药);BL-B01D1针对38例经过多次治疗(其中34例曾接受第三代EGFR-TKI治疗)的EGFR突变阳性NSCLC患者,ORR为63.2%,DCR为89.5%。

除HER3 ADC外,还有不少新型ADC药物展现出巨大的商业价值,涉及TROP2、Claudin18.2、Nctin-4、B7-H3/B7-H4、FRα等靶点。
例如,2020年,吉利德斥资210亿美元收购Immunomedics,拿下了全球*TROP2 ADC药物Trodelvy;2023年,辉瑞豪掷430亿美元收购Seagen,后者已获批上市的ADC药物Adcetris、Padcev、Tivdak分别靶向CD30、Nectin-4、TF,无一重样,同年艾伯维也以101亿美元收购ImmunoGen,获得了全球首创的FRα ADC药物Elahere。
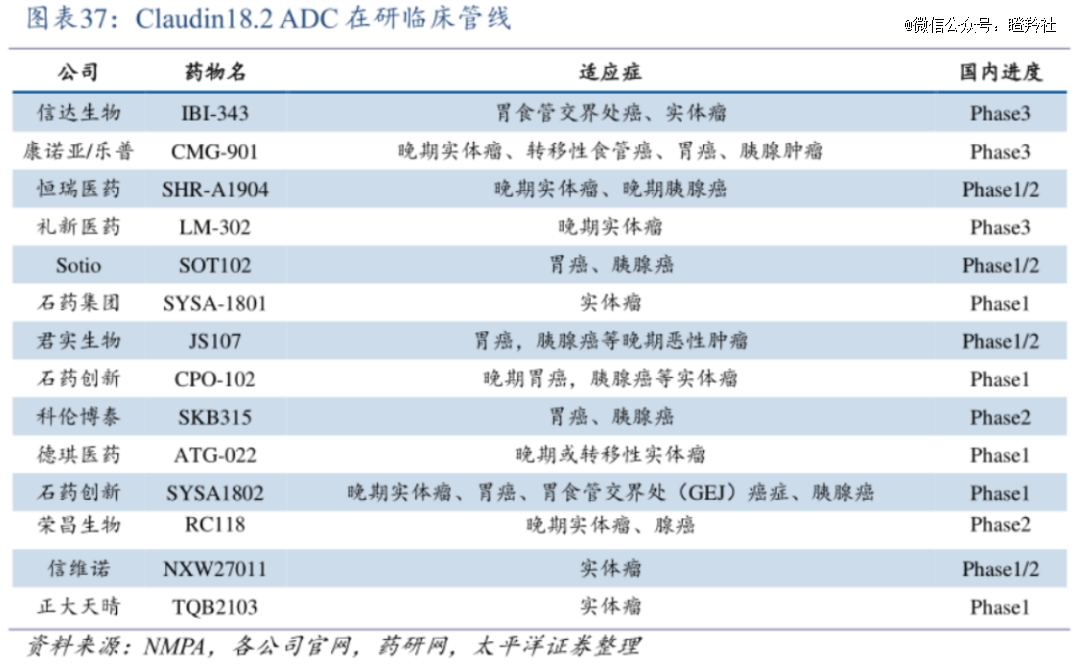
Claudin18.2作为广谱抗癌靶点,高度表达于胃癌、胰腺癌和乳腺癌等多个实体瘤中,也是必争之地。
据统计,目前已有5项国产Claudin18.2 ADC实现BD交易,包括礼新医药LM-302、科伦博泰SKB315、石药集团SYSA1801、康诺亚/乐普生物CMG901、恒瑞医药SHR-A1904,潜在总交易额合计超过50亿美元。其中,信达生物、康诺亚和礼新医药的Claudin18.2 ADC已进入III期临床。
此外,B7-H3和B7-H4靶点也受到MNC巨头的青睐。
2023年10月,默沙东斥资220亿美元与*三共达成3款ADC新药合作,其中除HER3靶点外,还有靶向B7-H3和CDH6的ADC药物;同年10月、12月,翰森制药分别将B7-H4 ADC药物HS-20089、B7-H3 ADC药物HS-20093授予葛兰素史克(GSK),合计潜在交易总额超过30亿美元。
当然,新型ADC药物走的都是前人没走过的路,必定会遇到研发风险。
例如,吉利德的TROP2 ADC药物Trodelvy,今年已接连在非小细胞肺癌、尿路上皮癌和膀胱癌适应症研发失败,而竞争对手科伦博泰/默沙东的SKB264/MK2870有望展现出BIC潜质,且默沙东已启动了9项全球III期临床,意在竞争中抢占优势。
另外,MacroGenics的B7H3 ADC新药Vobramitamab Duocarmazine,在针对前列腺癌患者的II期临床TAMARACK研究中出现5例患者死亡,导致股价暴跌近80%。
结语:归根结底,新药研发本就是福祸相依,机会与风险并存。
可即便新型ADC药物不定期爆出临床失利的消息,仍不会阻挡全球药企持续探索的脚步,尤其对于HER3、TROP2等广谱抗癌靶点,更是必须拿下的“金矿”。