小分子药物历久弥新。
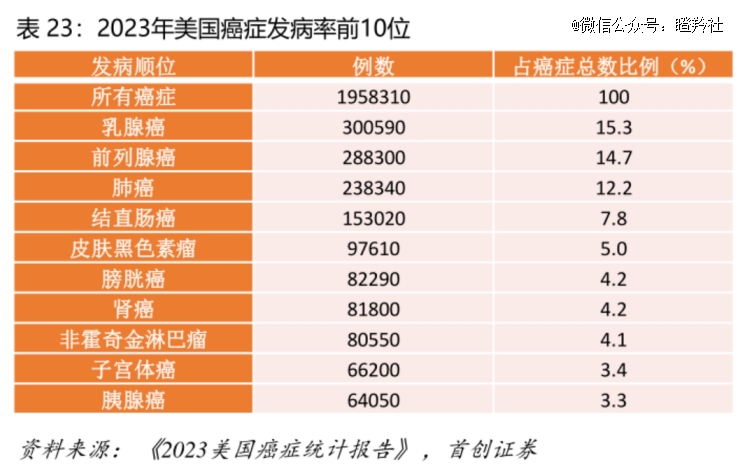
分别以美国男性和女性发病率*的癌症前列腺癌和乳腺癌为例,乳腺癌中占比近70%的HR+/HER2-分型一线治疗药物CDK4/6抑制剂“独霸江湖”,三款同类药物创造了百亿美元市场,市场规模稳步增长;前列腺癌更是如此,抗雄激素治疗的AR拮抗剂、CYP17抑制剂牢牢把握一线治疗市场,孕育出恩杂鲁胺、阿比特龙等重磅炸弹,市场规模同样超百亿美元。
如今,无论是CDK4/6抑制剂还是AR拮抗剂都仍然活跃在当今舞台上,其中最畅销药物哌柏西利、恩杂鲁胺上市分别超过9年、12年。
何尝不可以说“得前列腺癌、乳腺癌两大适应症者,得天下?”目前已商业化的药物中,极少数能够横跨这两大适应症,即便有也是极为广谱性的重磅炸弹。而在新晋的小分子新药中,有那么一个横跨前列腺癌、乳腺癌两大适应症“宝藏分子”,那便是AKT抑制剂。
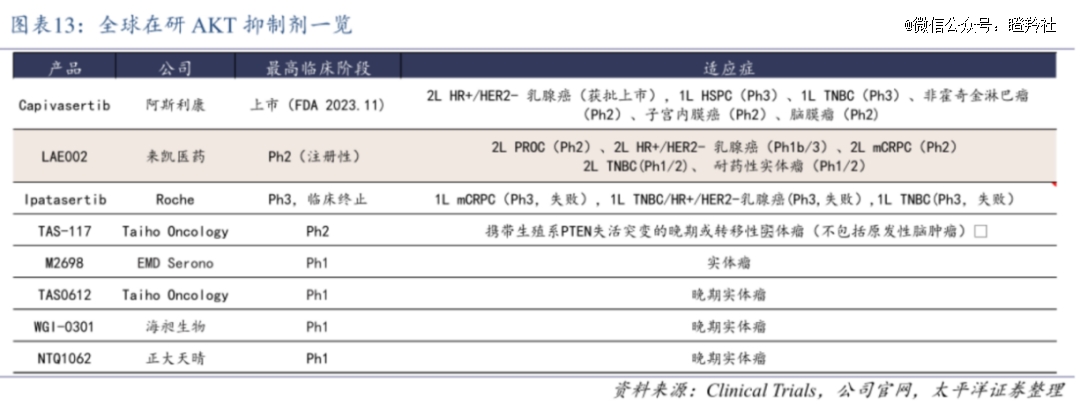
从全球研发格局审视,AKT抑制剂研发是*潜力而不拥挤的蓝海赛道,目前只有阿斯利康的Capivasertib获批上市,而来凯医药的LAE002(Afuresertib)进度全球第二,中 美两地已进入临床三期,两大领军企业进度远远甩开其他公司,中短期内是“绝代双骄”的竞争格局。
科睿唯安预测,阿斯利康的AKT抑制剂Capivasertib到2031年将在七国集团市场获得至少10亿美元的销售额;也有海外分析师预测,Capivasertib将在未来达到38亿美元销售峰值,这无不彰显了AKT抑制剂广阔的市场前景。
01 AKT抑制剂十八般武艺与来凯医药“Me better”
AKT是一种丝氨酸/苏氨酸蛋白激酶,为PI3K/AKT/mTOR信号级联的关键节点。AKT可以激活下游的效应分子(主要是mTOR蛋白),进而刺激肿瘤细胞的代谢生长和增殖、免疫逃逸和血管生成。其中AKT的激活过程可以被PTEN抑制,PTEN功能的缺失将导致AKT的过度激活,引起肿瘤的发生。由此,通过抑制AKT的激活,可达到治疗癌症的效果。
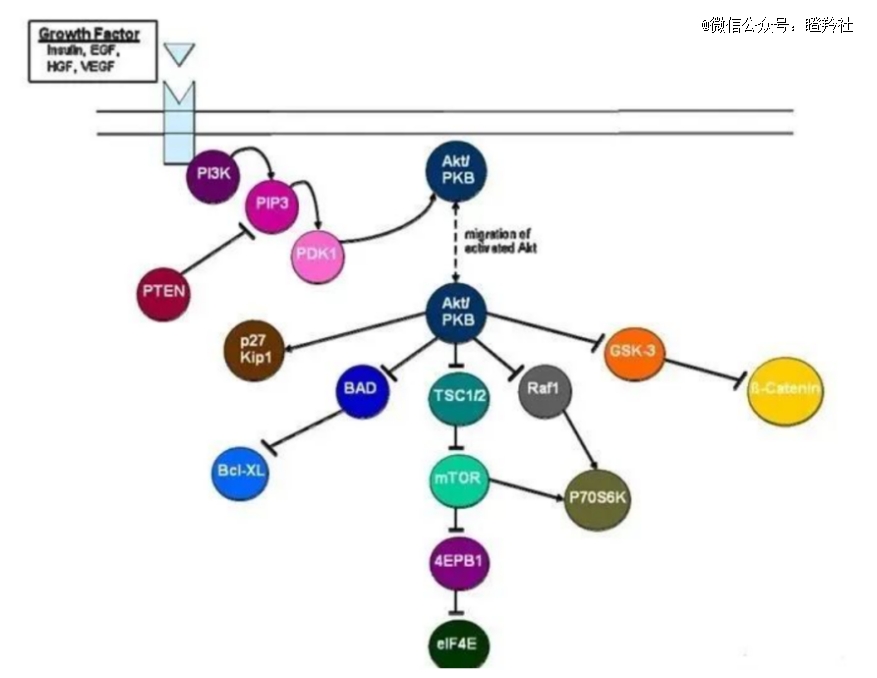
AKT靶点的广谱性和“十八般武艺”源于PI3K/AKT/mTOR 通路,该通路是人类癌症中最常改变的信号通路,38%的癌症患者中发现了 PI3K/AKT/mTOR 通路的改变;同时,该通路的过度活化广泛存在于各类癌种,包括乳腺癌、肺癌、头颈部肿瘤、子宫内膜癌、前列腺癌、结直肠癌等。
值得注意的是,AKT在PI3K/AKT/mTOR信号通路中处于核心位置,这个位置让AKTi对PIK3CA、AKT、 PTEN改变的患者都能获益,而PI3Ki只对PIK3CA突变患者有效。一方面对AKT抑制可以起到抑制肿瘤细胞增长的作用,另一方面,PI3K/AKT信号通路的活化可能导致多种小分子抑制剂的耐药和多类癌症的病情恶化,AKT抑制剂有望解决多类小分子抗癌药物的耐药问题。
目前,阿斯利康的AKT抑制剂Capivasertib已经获批了二线HR+/HER2-乳腺癌,同时还有去势抵抗性前列腺癌、三阴乳腺癌、非霍奇金淋巴瘤、子宫内膜癌、脑膜瘤等癌症处于中后期临床。
在已经获批的二线HR+/HER2-乳腺癌适应症中,Capivasertib凭借着三期CAPItello-291研究碾压性数据优势获得成功。在既往接受过CDK4/6抑制剂治疗的HR+/HER2-晚期乳腺癌患者中,并伴有PIK3CA/AKT1/PTEN 通路改变的人群,“Capivasertib+氟维司群”治疗组与“安慰剂+氟维司群”对照组对比为7.3个月vs 3.1个月(HR=0.50)。基于CDK4/6抑制剂耐药后巨大的未满足临床需求,FDA授予了capivasertib该适应症的优先审评,并于2023年11月批准其在美国上市。
尽管Capivasertib疗效优异,但其安全性信号也备受市场关注,CAPItello-291研究中,治疗组的不良反应率高达96.6%(对照组82.3%),严重不良反应率为16.1%(对照组仅有8.0%),因不良事件中止治疗的比例13.0%(对照组2.3%),这也给后来者留下了*的机会。
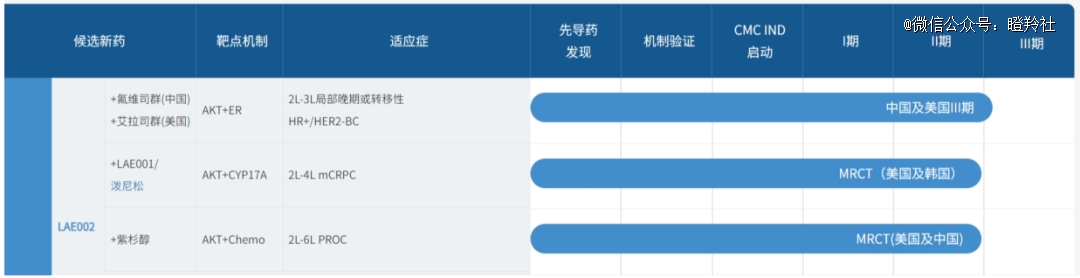
紧随Capivasertib其后的来凯医药LAE002是潜在“同类*”AKT抑制剂,其优势体现在几个大的方面:
1)临床前数据支持:对比同类竞品,LAE002对AKT的抑制效力更强,脱靶效应更低,这意味着该分子的有效性、安全性潜力更强;
2)给药频次:Capivasertib给药方式为连续给药四天,停药三天,可能是由于药物的耐受性原因无法连续给药;而来凯医药LAE002可维持每天给药,不存在间隔给药限制;
3)已有临床数据:在非头对头数据比较下,LAE002在效力、肿瘤抑制暴露和毒性方面具有优势,安全性更好。
来凯医药LAE002作为潜在有效性&安全性更佳、治疗窗口更宽的AKT抑制剂,无疑能够放大AKT抑制剂癌症治疗市场的价值。
来凯医药正推动LAE002在两大癌种前列腺癌、乳腺癌临床探索上高歌猛进。
(图源:来凯医药官网)
02 晚期乳腺癌耐药大市场
5月30日,来凯医药宣布国内LAE002治疗HR+/HER2-局部晚期或转移性乳腺癌临床三期AFFIRM-205研究*患者入组,据悉公司在国内合作了47个临床中心,*患者入组意味着公司三期临床加速启动。
本次LAE002瞄准的乳腺癌适应症,背后蕴藏的市场潜力巨大。WHO国际癌症研究机构(IARC)数据显示:2022年全球乳腺癌新发病例数预估达229万人,约有66.6万患者因此死亡,而中国新发病例预估35.7万;在美国所有类型乳腺癌患者中,大约69%属于HR+/HER2-,中国乳腺癌患者中这一类亚型比例为62%。
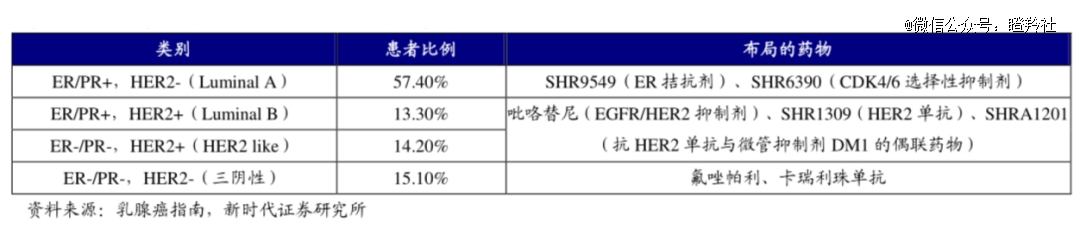
HR+/HER2-晚期乳腺癌,目前一线疗法是内分泌治疗联合CDK4/6抑制剂,15%-20%的患者对治疗产生原发性耐药,30-40%的患者会随时间对治疗产生耐药性;二线标准疗法基础药物ER降解剂氟维司群虽然疗效有限,但仍然在过去二十年独占SERD靶向药市场,销售额峰值高达10.28亿美元。
HR+/HER2-乳腺癌患者CDK4/6耐药问题一直是二线治疗的一大痛点,不过其耐药的机制多种多样,主要包括ESR1基因突变(ESR1m)、PI3K/AKT/mTOR信号通路表达上调、BRCA2基因突变(BRCA2m),数据显示上述分型占患者比重分别为30%、50%、12%。
PI3K/AKT/mTOR信号通路表达上调人群占据了CDK4/6耐药乳腺癌后线患者的半壁江山,对照氟维司群在2018年达到的10.28亿美元销售峰值,该领域AKT抑制剂及组合疗法市场至少在20-30亿美金以上。
在前文提到,AKT抑制剂先驱Capivasertib在三期临床中以亮眼的获益数据取得成功,在HR+/HER2-晚期乳腺癌取得双倍PFS获益,其中有69.1%的患者经过CDK4/6抑制剂治疗。
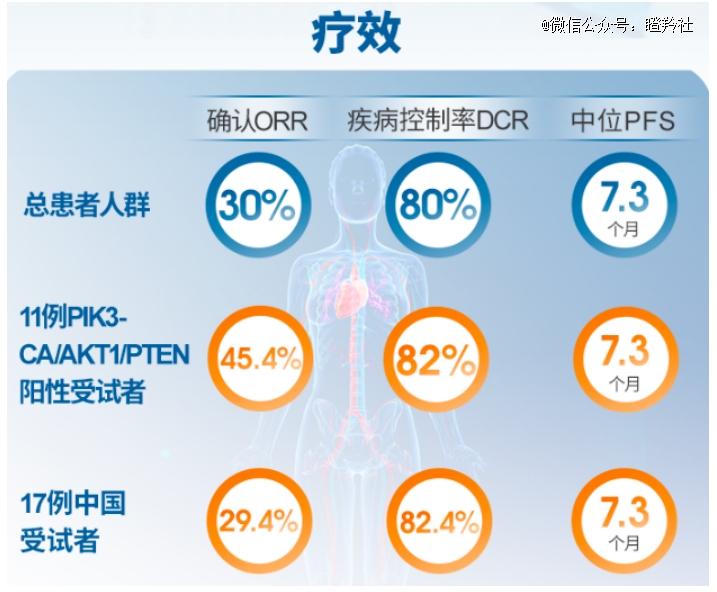
来凯医药LAE002,则是在早期的临床数据中看到了优于Capivasertib的积极讯号。2023 SABCS大会上,来凯医药公布了LAE002联合氟维司群治疗HR+/HER2-乳腺癌二线治疗1b期临床数据:在20位受试者中,全人群治疗组ORR为30%、DCR为80%、mPFS为7.3个月;在11 例PIK3CA/AKT1/PTEN突变患者中,ORR为45.4%、DCR为82%、mPFS为7.3 个月。
非头对头的数据比较上,LAE002小样本临床数据对比Capivasertib三期数据取得了更好的ORR,尤其在PIK3CA/AKT1/PTEN突变患者中,ORR的获益更加突出,这也符合LAE002临床前对AKT的抑制效力更强的数据。值得注意的是,两个临床CDK4/6经治耐药患者比例相差无几,基本验证了AKT抑制剂作为CDK4/6耐药后线治疗标准的潜力。
(图源:来凯医药官微)
更惊艳的可能是LAE002表现出的安全性,亮点包括未出现因不良反应停用药物事件(Capivasertib有13.0%)、观察到的大多数不良事件为1级(未出现4级及以上安全事件)、临床中未进行剂量调整(Capivasertib有约20%患者调整)。
安全性大概率将成为LAE002后发制人的一把利剑,乳腺癌后线治疗患者经历多重治疗后普遍免疫力较弱,LAE002凭借安全性优势不仅有望扩大不同适应症的受益人群,同时提升临床医生的用药接受度,为该药物在未来商业化竞争层面打下坚实基础。
03 掘金转移性去势抵抗型前列腺癌蓝海
也就是上周的5月23日,来凯医药宣布LAE002联合LAE001治疗转移性去势抵抗性前列腺癌(mCRPC)患者的III期临床试验方案获得FDA批准。经此批准,意味着LAE002在mCRPC适应症的差异化布局上*阿斯利康的Capivasertib(局限性前列腺癌三期)。
显然,LAE002选择了一条更难的道路,但一旦成功,回报丰厚。
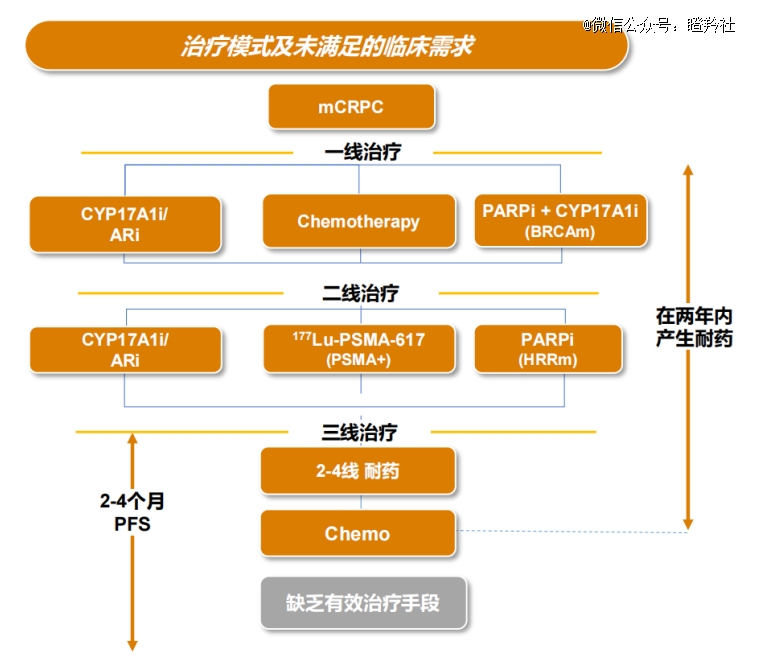
前列腺癌的进展路径一般是“局限性前列腺癌→对雄激素剥夺治疗(ADT治疗)敏感的转移性前列腺癌→对ADT治疗耐药的非转移性前列腺癌(nmCRPC)→mCRPC”。
mCRPC是一种恶性程度较高的癌症,患者生存时间较短,5年生存率不到30%。同时,前列腺癌人群基数和新发率较高,形成了潜力巨大的治疗药物市场。2020年数据显示,每年前列腺癌有141万新发癌症病例和37.5万例死亡。
(图源:来凯医药DJSeedin大会材料)
目前,mCRPC一线治疗手段为化疗、CYP17A1或AR抑制剂、ADT治疗还有PARP与CYP17A1抑制剂组合疗法等;再看二线mCRPC治疗,可以分为PSMA表达、HRRm基因突变等患者分别进行诺华核药Pluvicto、PARP抑制剂进行个性化治疗,普遍来看,该类基线患者患者中位生存期不足两年,且极其容易耐药,这代表着二线mCRPC治疗存在极大的未满足临床需求。
研究人员发现,约50%-70%的mCRPC存在PTEN功能丧失导致PI3K/AKT/mTOR通路过度激活,导致了前列腺癌患者较高的不良预后和耐药性。所以,AKT抑制剂联合CYP17A1抑制剂的组合疗法被市场视为有望解决耐药问题的二线mCRPC治疗手段。
来凯医药此次海外大三期临床的获批,来源于药物早期疗效数据的底气,不仅基于LAE002,更包括组合疗法的另一个分子LAE001。
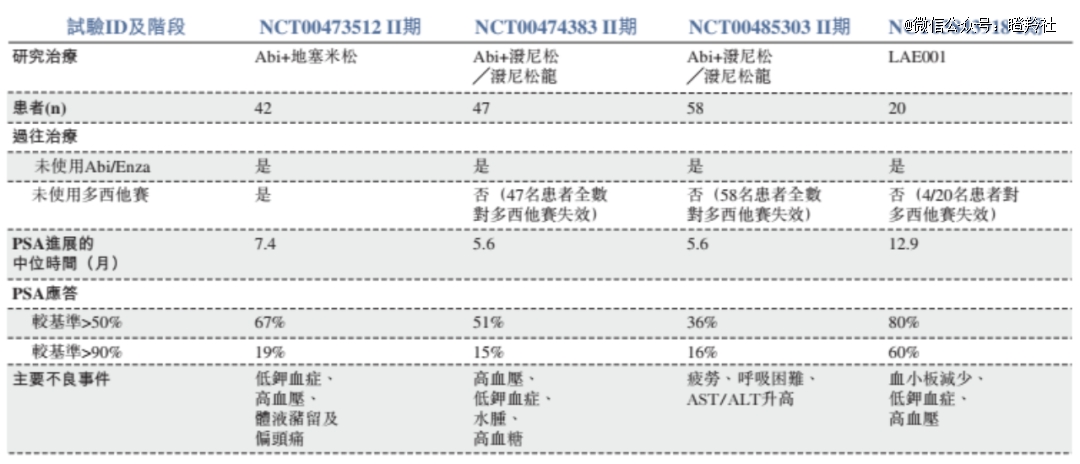
LAE001是全球*CYP17A1/CYP11B2双靶点抑制剂,相比前一代药物阿比特龙,增加靶向CYP11B2能够降低盐皮质激素过量效应,同时该药物对CYP酶具有高选择性,进一步提升了药物的有效性和安全性。
在LAE001已披露的治疗mCRPC一期临床数据显示,在20名可评估的患者中,80%患者PSA应答下降超过50%、60%患者PSA应答下降超过 90%,其初步数据远胜于阿比特龙与地塞米松或泼尼松龙的组合疗法。
(来源:来凯招股书)
LAE002+LAE001组合疗法数据则是更为惊艳,截至2023年11月21日,其二期临床数据显示:在40名中位数为二线的mCRPC患者(阿比特龙和/或雄激素受体拮抗剂治疗)中,rPFS高达8.1个月;参考三线mCRPC治疗中rPFS为2-4个月,可以判断LAE002+LAE001的组合具备显著的核心竞争力。
另外惊艳的还有安全性数据,上述试验大于三级的不良反应主要为血小板减少症(7.5%)、贫血(5.0%)、高血糖(5.0%)、低钠血症(5.0%)和高血压(5.0%)等,相比其他同类试验动辄大于50%的三级不良反应事件发生率,可以判断LAE002+LAE001组合疗法前景广阔。
不少投资者将诺华Pluvicto视为众多研发mCRPC治疗药物的强大劲敌,同时其也是全球最快到达10亿美元收入的核素偶联药物。值得注意的是, mCRPC患者中有发生PSMA突变的比例约为80-90%,非PSMA突变的患者Pluvicto疗效有限;但LAE002+LAE001组合作为二线mCRPC治疗中机制明确、疗效优异、安全性*的有力竞争者,若在海外三期临床顺利兑现,潜力可想而知。
对于来凯医药来说,LAE002+LAE001组合的推进和兑现,将是决定公司价值双击的重要构成因子。
结语:阿斯利康Capivasertib的成功,已经为AKT抑制剂验证了成药性和潜在的市场空间,对于手握已经进军前列腺癌、乳腺癌等大适应症三期的Me better或Best in class分子的来凯医药,我们有理由更期待其未来的发展,更别说还有潜在强催化的GLP-1减肥伴侣——自研的LAE102(ActRIIA单克隆抗体)。顺道提一句,LAE102已经获得了中 美两国的IND批准,即将启动肥胖症受试者招募。