

最近,李黎为服务的TOP 10跨国药企发出了一份药物管线授权(BD)需求:寻找处在二、三期临床或已上市的GLP-1靶点等治疗肥胖/超重适应症的产品。令他惊讶的是,短短两天内,联系他的“不错的企业”有7、8家之多,甚至还包括上市公司。
“如果不是资本寒冬,我认为不太可能有这么多优秀、知名的企业愿意做这件事。”李黎判断。
生物医药领域资本市场寒冬的大背景下,将管线授权给跨国公司(MNC)、快速变现,成为2023年以来最为中国医药企业津津乐道的出海方式之一。叠加国内政策变化带来的市场“缩水”,海外市场的想象空间和生存可能性显然更为诱人。
过去一年,中国创新药集中迎来出海爆发:审评审批上,君实生物、和黄医药的两款自研新药先后在美国上市,打破了2022年来一直弥漫的“中国新药出海受阻”消极氛围;对外合作上,跨境对外授权(license out)披露金额超过400亿美元,抗体偶联药物(ADC)创下单笔交易近百亿美元的成绩;市场销售层面,*国产“十亿美元分子”出现,2023年百济神州BTK抑制剂泽布替尼的全球收入达到13亿美元。
这些现象背后的最明显信号是,现阶段的药品出海,比的是创新,拼的是专利。
不再是妄图用同质化的“Me Too”产品敲开全球*药物市场的大门,不再是靠小适应症挤进美国食品药品监督管理局(FDA)的审评通道,也不再是用低价策略占领市场。如果说,2021年之前几乎“看不到什么像样的出海案例”,当前的出海,则是中国医药行业经历过去10余年投入后,“创新集聚效应”开始进入收获期的体现。
于是,当中国创新药企业开始用质量向世界证明产品的独特性和差异化,厘清变化发生始末和当前需求,就能更好寻找新的机会。因此,本文将试图回答:
1、相较传统交易,新的出海会以怎样的形式持续?
2、这一过程中,MNC想看的和Biotech需要的出海能力是什么?
3、内卷还是机遇,怎样看待热门靶点/适应症中的新机会?
4、谁在享受出海收益:药企核心资产BD后对IPO或机构退出的影响。
1、卖产品转向卖专利,出海有了“双选”权力
在一部分行业人士看来,相较过去靠自己“苦哈哈”地推海外多中心临床,直接把有价值的管线拿到美国当地去由本土企业做孵化,做出临床价值再找MNC合作或融资、上市,已经成为一个更通顺的路径。
变化是从新冠疫情前悄悄发生的。“企业真正开始重视BD,是从2018年国家药品集采开始的。”医药跨境投行BFC Group创始人/董事总经理陈大东(David Chen)解释。
在此之前,原料药、仿制药低价走量的海外出口更为人熟悉。集采、国家医保谈判政策陆续在2018年启动后,行业开始重新思考创新药的“中国定价”问题。只是受疫情、研发进展等因素影响,当时尚未明显体现出来。直到2022年募资寒潮出现,“很多企业真的开始着手做这件事”。
常规BD谈成一般要1-2年,加上“很多MNC要赶在年底前把预算花完”,一部分创新药企业也需要赶在1月的摩根大通医疗健康年会(JPM)上展出更多的成果,去寻求新的授权或合作空间,2023年年底呈现出的BD热由此而来。
这一过程中,药品出海从贸易端走向研发侧,本质上是中国制药行业基调在发生变化:当出海的概念不再停留在“去美国建一座工厂”,或者拿下某个领域的市场,卖的其实就不再是产品,而是“知识产权”。
这在一定程度上给了中国创新药企更多的选择空间。
形式上,一方面,更多的“新内容”,比如投资、合资、期权以及优先谈判权等辅助条款逐渐被纳入到了交易合作中,授权合作的模式更加多元化。
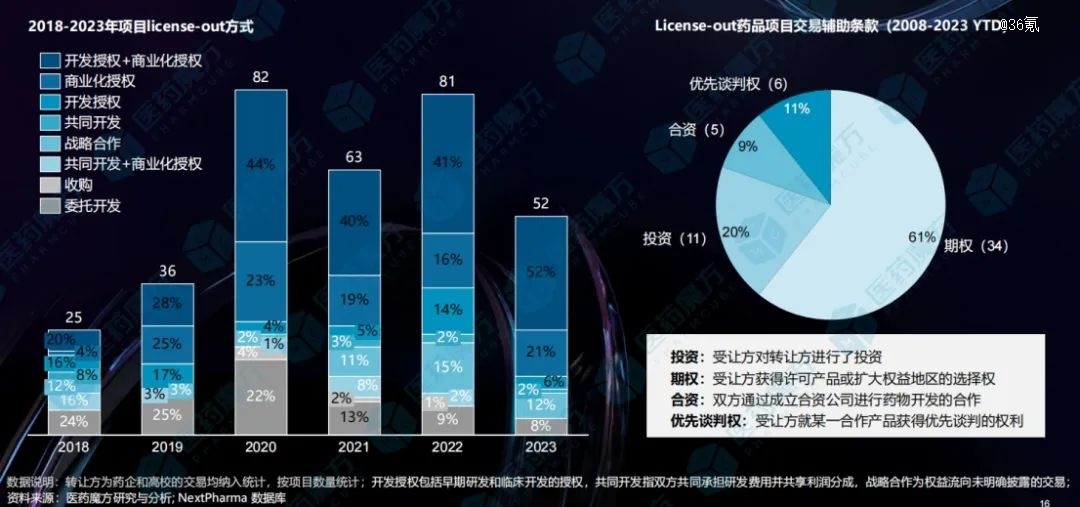
数据来源:医药魔方
另一方面,选择合作伙伴的话语权变得更大。自研结直肠癌新药呋喹替尼在美国上市后,和黄医药方面也和36氪解释了当前中国企业出海的选择问题:多数情况下*MNC,因为“无论从支付能力、基础设施,比如注册、商业化团队经验;还是长期生命周期管理,比如新适应症开发、大型临床研究开展上都会更有信心”。比如呋喹替尼与武田制药的销售合作,就是看中了后者在消化道领域的强势地位。
与此同时,新冠疫情之后,除了MNC,很多欧美中小型企业,包括未设立办事处的那些,都在通过亲自前来或咨询公司服务的方式进入中国。
“其实美国很多Biotech的CEO就是‘二传手’‘窜班子’的角色,他们有过多次成功创业经验,融资能力非常强,而且非常专业。他们可能也没有能力拿很后期的项目,但擅长找科学家,或筛选有潜力的早期项目放到资本市场上去讲故事、拿钱。”一位港股创新药企业创始人谈到。
过去一年,这位创始人就“接待了很多这样的人”。
对卖方而言,现阶段将管线权益拆分出去,无论是以直接卖还是自己在海外成立子公司等迂回方式,都能更好缓解母公司资金压力,“熬过这段时间”。
相较MNC,和这类企业 “做生意”的好处在于,他们的决策周期更短,可以直接“让创始人拍板”。
从客观结果上来看,一些被引进海外市场的“国产分子”表现的确不俗。比如1月底,ArriVent BioPharma成为今年第二家在美股上市的生物科技企业,核心管线就是从艾力斯引进的第三代EGFR-TKI药物伏美替尼,其主要适应症是针对EGFR 20号外显子插入突变的非小细胞肺癌,比例不算高,但亚型有100多种,成药概率小,也曾是众多跨国药企曾折戟的领域,最突出的特点就是差异化。这也成为支撑Arrivent快速上市,且IPO募资超额的原因。
“中国药企的创新值得这些结果,”一家ADC企业的创始人半开玩笑称:“2023年夏天我去参加ASCO年会的时候,美国很多药企研发人员还在居家办公呢,我们早就‘卷’起来了。”
2、资源在向头部聚集,签下合同的“1%”是谁
最近一段时间,海外生物医药投资走出资本寒冬“阴影”的步伐,相比国内的确要更快一些。比如高盛近期完成6.5亿美元的首支针对生物科技行业的私募基金,被视为生物科技行业又迎来投资好时机的信号。当海外大小药企急于借力弥补损失时,“自然会看到中国同行的研发成果”。
那么,在2024年,一家跨国药企可能怎样筛选项目?
以一家以免疫学闻名的头部跨国药企为例,36氪了解到,从其过往两年表现来看,一年评估的项目数量达到2000个以上,但能签下保密协议的其实只有10%,走到合同谈判的仅为1%,而真正执行的交易,甚至还不到这个比例。
这个过程“成熟且科学”,评审和人员维度十分多样,大致可分为三类:首先是早研阶段的项目搜索、基因组学研究、临床前毒理学研究;临床阶段,涉及临床开发、药理学/药物剂量学、药物警戒、CMC/运营等;最后才进入商业化报批、准入&定价、专利等流程。“要通过综合性模型来测算产品未来的潜在销售额和利润,项目越是早期,流程就越复杂。”
“想‘卖专利’,通过和MNC进行BD的方式来出海,开发进展和临床安全、有效性非常重要。同时制备工艺的可行性、稳健性,包括成本控制也是判断标准。不过现阶段,中国的出海项目仅凭数据就能惊艳MNC、且确定能成药者少之又少。综合实力,比如经验、人、运营状况非常重要。”David Chen提到。
2023年年底,诚益生物和阿斯利康就前者的口服小分子GLP-1受体激动剂ECC5004达成的合作就是很典型的例子。这项交易涉及ECC5004在中国以外所有国家和地区、所有适应症的开发和商业化*权益,首付款1.85亿美元,总价达20亿美元,预计在今年启动二期临床试验。
除了押中口服GLP-1这个“风口”之外,ECC5004的一大突破点在于结构式设计,做到了在和“头号玩家”礼来那款已经进入临床三期阶段GLP-1小分子药的结构式非常相似的同时,又避开了核心专利。可以理解为阿斯利康本质上是在花20亿美元买一个新分子,且耐受性良好,副作用减少,低剂量的服用方式也能够实现用更简单的制造方法来降低成本。
据36氪了解,由于这几点优势,两家公司虽“接触比较早”,但真正开始交易时,其实只用了数周时间就达成了合作。
从总数上看,2023年中国药企跨境License out数量达到了71起,披露金额达413亿美元,多个项目首付款超过亿美元,创下数量和质量新高。
不过,如果把这个数字放在中国几千家Biotech这个大盘子里看时,整体出海比例只有不到0.5%,而且大额交易多数还是集中在已经上市,或轮次靠后的企业中。比如过去一年,单笔交易超过10亿美元的案例还是集中在恒瑞医药、科伦药业等老牌药企身上。
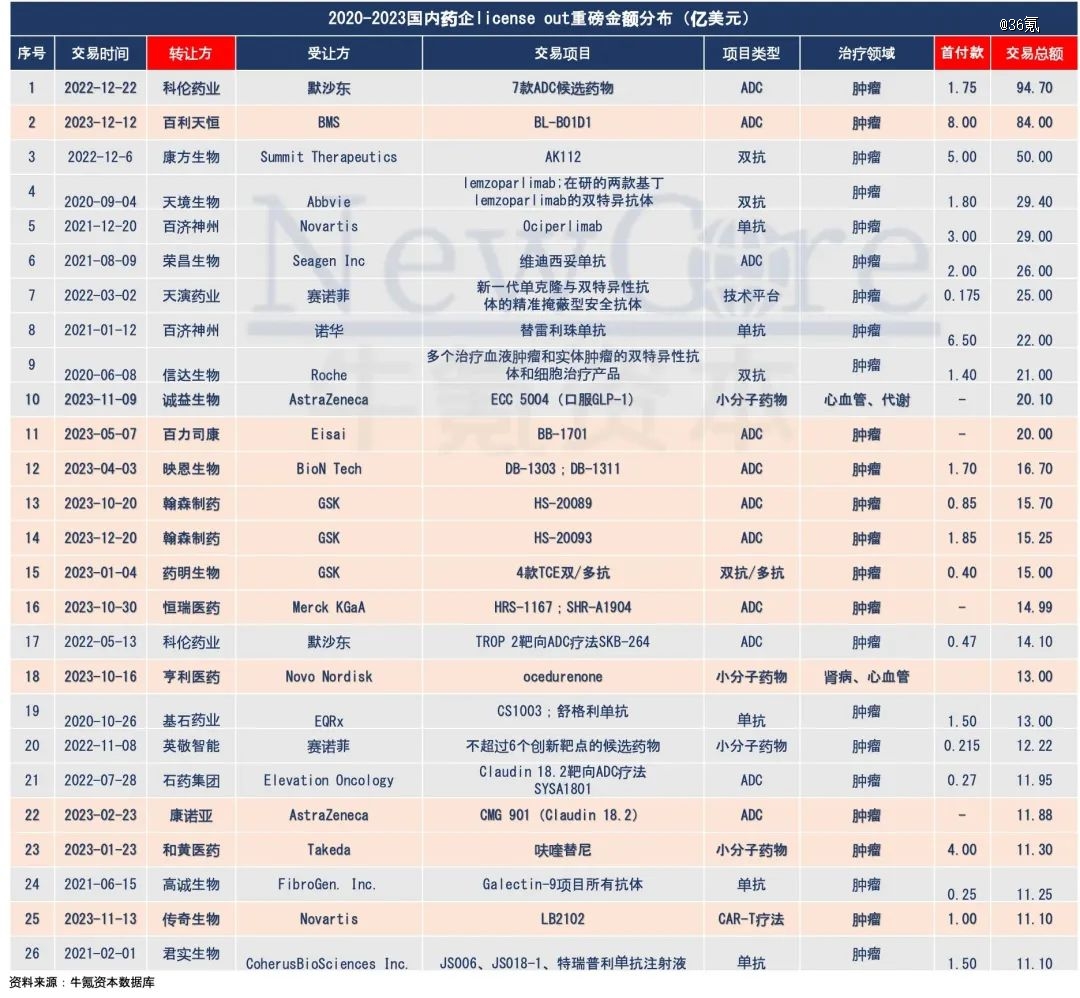
数据来源:牛氪资本数据库
David Chen认为,这些现象透露的信号是,未来创新药出海的马太效应会更加明显,资源正在向已经有交易达成的企业倾斜。“MNC也更喜欢跟大企业打交道,他们觉得大企业做出来的数据,特别是在工艺开发、生产这方面更有经验,东西更靠谱。”
对于早期创业企业来说,影响就更为明显。做数据需要烧钱,想通过BD出海来募集资金的,“前20%已经做的了相对容易一些”,后来者很难再喝到汤。“其实这也是在为投资人做筛选。现阶段,已经有成功MNC交易背书,或者评估后有出海潜力的企业才能募到资,如果给人家的感觉是你一点国际化能力也没有,这个企业要活下来很难。”
这部分“国际化能力”,其实也是中国医药企业整体面临的一道门槛。具体表现在海外团队建设比较弱、管理能力比较差、资金薄弱,以及跟海外大PI(临床试验中的主要研究者)的关系不强等方面,“都需要时间去建设”。
硬实力外,前人一些经验上的教训也值得警示,首先在于材料准备的基本功。“中国企业现在的通病是包装能力非常差,基本功做得不算太好,项目发过去可能还有语法错误。不是所有人都像你一样懂自己的项目,人家一年评估2000-3000个项目,给你的时间可能最多就20分钟或半小时,你再让人家在材料里到处找亮点,很可能机会就没了。”
此外,在尽调环节上,一些企业也会面临“招架不住”的问题。“有的创业公司才十几号人,也不是每个人的英语都足够好。MNC尽调涉及的部门就有十几个,问题全甩过来时自然会发生答不上来的情况。这些需要一定经验,但其实都是中国医药企业有能力去做的,只是要引起足够的重视。”
3、选适应症,买家要看“资金使用效率”
“人、财、创新的集聚效应”,David Chen这样概括当前BD出海繁荣的局面。“我的一位欧洲客户对此也有感触,感觉新冠疫情后,中国突然就有很多创新冒出来了。这是因为创新到了一定程度,就会有聚集效应出现。”
2010年之后的医药人才归国,2019年之后国内一、二级市场“真金白银砸进去”的投资,以及中国丰富的临床资源,共同搭建出当前的中国创新药生态体系。
如果从疾病领域的看,肿瘤显然是最为突出的。据中国国家药品监督管理局数据,过去一年获批上市的66款创新药中,抗肿瘤新药一如既往保持在头位,数量达26款,占比近40%。这其中固然有临床需求的成份,但也在一定程度上造成了“内卷”。早年间的“替尼”热,后来的PD-1,以及近期的ADC,案例源源不断。
传导至BD出海一端时,也能够看出,当前这一阶段的成功交易无论从数量还是金额上,多集中在肿瘤领域。2023年,12起金额超过10亿美元的单笔跨境交易中,有10起与肿瘤相关,其中百利天恒与BMS的ADC授权总价达84亿美元,创下了ADC领域单笔*BD交易记录。
客观而言,其实正是因为赛道“热门”,才给了更多资本进入,更多创业者参与的机会。前述ADC企业创始人喜欢用当年艾伯维收购Stemcentrx后,获得的DLL3靶点ADC药物Rova-T来解释这个问题。
这也是曾备受医药行业关注的一笔案例。DLL3一度被视为*潜力攻克小细胞肺癌的靶点,正因如此,Rova-T亮眼的二期临床公布后,艾伯维斥58亿美元巨资完成这笔收购。虽然最终多个三期临床试验的失败让艾伯维在2019年时放弃了这款产品,但随后逐渐兴起的ADC热潮,让更多后来者选择继续尝试在这个靶点上做探索,在克服了linker不稳定带来的毒副作用后,“DLL3靶点ADC正呈现卷土重来的趋势”。
“这个案例教给我们的*教训就是,重磅交易并不一定走向必然的研发成功,个别项目的失败也同样不意味着靶点和赛道的完全终结。”
但如果意在海外市场,疾病选择还是要和国际接轨。从审评审批方面,FDA过去一年批准的新药中,罕见病已经成为超越肿瘤的存在,传染病、自免疾病、中枢神经系统类疾病等领域的药品占比也在提高。
David Chen也提到,从和MNC的交流上来看,他们如今对自免、代谢、神经,乃至眼科、孤儿药的兴趣相对更大。
“我个人认为,过去这些年投入过分集中在肿瘤领域,资金使用效率其实不算高。打个比方,如果一个成熟肿瘤适应症有30家企业在做,一定是赚不到钱的;但一些非肿瘤领域,比如自免和代谢,它们的市场会超过需要不断在适应症上做分型的肿瘤。”
过去一年,GLP-1在全球的爆火在一定程度上印证了这个方向。完成与阿斯利康的交易后,诚益生物创始人、首席执行官周敬业曾对36氪等媒体表示,接下来GLP-1赛道中有竞争力的产品其实就是两类,多靶点的多肽类注射药物和口服小分子GLP-1受体激动剂。前者胜在疗效,更适合严重的糖尿病/肥胖症患者群体;后者不仅仅需要做到速度快,还要形成差异化。
但在GLP-1领域,竞争格局其实已经基本定型,能让后来者“挪腾”的空间很小。多位药企人士判断,在中国,现阶段最有可能接棒形成出海热潮的BD方向是小核酸药物。
一方面,这类药物在技术上同样涉及许多改造问题,是“中国企业更擅长做的事”;在竞争格局上,真正获批的新药并不多,且当前全球小核酸药物开发的核心在于肝外递送系统的开发上,中国企业和海外的进展“几乎站在同一起跑线”,更具反超条件。
今年年初,已有两笔大额BD点燃了市场的热情:先是瑞博生物与勃林格殷格翰达成20亿美元合作,共同开发治疗NASH(非酒精性脂肪肝炎)的小核酸创新治疗;随后,舶望制药宣布和诺华就RNAi(小干扰RNA)疗法达成两项*许可合作协议,集中在心血管和代谢疾病适应症上,总价达到了41.65亿美元。
4、BD出海对比IPO,更有效的“快速收益”方式
BD、并购出海的情况*火热,本质上也是由于泡沫出清迟迟未结束,作为中国生物医药企业最重要退出通道的科创板第五套规则和港股18A变得“失灵”,IPO发行数量和募资规模难以为继。
这个势头之下,一些更现实的问题也在逐渐引起讨论:一方面,以生存为前提的交易背景下,出售核心药物管线对公司后续价值/上市进程是否会产生影响;另一方面,市场普遍认为IPO还是主要退出渠道,转让权益会不会降低企业价值、影响收益?
一位LP背景的生物医药投资人对36氪解释,针对前者,主要从两个维度考虑。首先在于时间:当前,国内大部分投资人是以财务收益为主要的目的,也就是到底在现在收回一部分收益,还是等到未来“养肥了”再卖,获得更高的价格。“类似于跷跷板两端,需要取舍。”
如果现在通过BD交易或并购可以获得一部分划算的收益,自然就支持企业在出售,即便它是核心管线。资本具有时间价值,提前收回“能够让我在计算内部期间收益率的时候有一个比较合理的结果”。
事实上,在创新药BD出海成势的情况下,押注“创新药企的某一条管线”,待到其成功授权出去,拿到首付款后就先获得一笔收益,正在成为一部分投资机构尝试的方法。
这是所有人喜闻乐见的局面。时间太长“会增加不确定性”,投资人、企业,甚至是第三方服务商都明白这个道理。多位从事BD交易服务的第三方机构对36氪提到,现在企业客户其实都在讲,“能卖就尽量卖掉”。
“现在找来想做出海的中国企业特别多,”李黎表示:“过去,他们倾向于许可海外权益,保留大中华区权益,现在包括一些明星企业的口径都变成了‘灵活可谈’,如果MNC喜欢,愿意出让全球权益;管线上,有些企业会直接把管线里的产品都给我们去帮忙找买家,有人买就愿意谈。”
其次,从收益和风险维度,提前BD虽然看起来会给未来的收益造成一定影响,但也转嫁了风险。新药研发九死一生,能成功IPO者更是寥寥,“参考过往10年医疗行业企业IPO的成功率,说10%都算高”。在一些企业人士看来,出售的权益“本质上也是自己没能力消化的”,只要别被退回,卖给MNC拓展全球市场并不算亏。
对于一部分机构来说,如果在靠近IPO的轮次的时候进行投资,等待上市的确是其主要目的,或许很难容忍企业卖掉核心管线,李黎就曾遇到过客户“生意谈得差不多了,但法务过来说筹备上市,不能卖”的情况。但其实,国内“投资医疗行业的投资机构大部分是在更早期,或者成长期就投了这一家公司”,BD或并购掉意味着能够产生一些投资收回,未必需要再IPO。
“在海外,90%以上的企业都是通过被并购退出的。从这个角度,中国企业其实在慢慢和国际化接轨,这个趋势不可阻挡,因为最终能让投资人赚到钱的可能还是并购方式。”
近期,市场上的案例也的确让大家相信,退出的方式正在多元化。比如去年年底一项颇为医药圈乐道的收购案例:阿斯利康溢价86%,以12亿美元总价收购亘喜生物,后者由此成为中国首家被跨境完整收购的生物科技公司,这距离其在美股上市刚刚过去2年多。从业务层面,亘喜生物在自免疾病领域的CAR-T细胞疗法能够和阿斯利康在这方面的布局形成补充。
最终,按照阿斯利康给出的最高每份ADS11.5美元的收购价格,亘喜生物背后的一级市场投资机构及二级市场定增机构将全部获利退出。
“当大家确实看到成功的退出方式不仅限于IPO时,也就不会只是在意转让是否会影响公司价值。现阶段,投资人也是乐意去促成这件事的。”
5、万全之策难寻,性价比是长期命题
去年下半年以来,批量的药品出海交易成为中国药企创新水平正在融入全球竞争的阶段性证明,但仍有一些“顾虑”可能需要前置思考。
一方面,在高风险的创新药研发领域,被MNC“翻牌子”不等于一劳永逸,单笔交易可以被视为实现价值的手段,但更久之后的效益,即被BD药企视为“长期收益来源”的研发里程碑付款或商业化分成,都要依靠产品本身的效果来支撑。
另一方面,从更长期的角度来看,“全球都处在紧缩的状态”。有投资人提到,除“美版医保”正在尝试的首批10款处方药降价方案外,去年年底FDA接连批准的两款同适应症、但价差高达近万百美元的CRISPR/Cas9基因编辑疗法,也能够说明一定问题,就是“大家都在寻找性价比更高的方案”。
尽管,短期之内这或许不会成为中国创新药企在出海时需要特别重视的问题,但至少说明,即便是成功出海之后,考验也远远没有结束。
基于现阶段情况,多位投资人,以及来自不同赛道的医药企业人士都认为,至少在2024年,BD/并购出海的案例还会源源不断涌现,但“更久之后还会不会持续”,可能也要看*批,也就是当下这批出海案例的临床数据或市场表现究竟怎样。





