

数十年来,我们习惯了阿尔茨海默病(AD)药物研发的失败,毕竟近20年,获批上市的AD药物寥寥无几。
然而,从今年初开始,情况似乎起了变化。1月,卫材的Lecanemab获FDA加速审批;7月,Lecanemab获得FDA完全批准,就在获批当天,美国Medicare将Lecanemab选定为保险适用对象;10月,Lecanemab通过海南药品监督管理局审核落地海南博鳌乐城国际医疗旅游先行区,预计最快将于2024年上半年完全在国内获批。
Lecanemab的获批回答了一个AD药物领域最关键的问题,这条路到底走不走得通?同时,新药的获批也意味着今后AD赛道将发生更多的变化。
就在11月,礼来首席科学家宣布其AD新药Donanemab取得“重大突破”,受此消息影响,礼来股价上涨4.82%,达到595美元。
一时间,数十年来围绕在阿尔茨海默病上空的阴霾似乎开始消散,研究人员多年的摸黑探索后或将迎来突破的希望。
01 倒在半路的先行者
临床失败率高达99.6%,AD药物一度被喻为研发黑洞。
随着社会老龄化程度的加深,AD所引发的社会问题变得越来越复杂,可多年以来,业内对于这座堡垒的进攻却没获得实际的进展。
Clinicaltrials上的临床数据不会骗人。2002年~2012年之间,总共有413次关于AD药物的试验,其中1期124次、2期206次、3期83次。其中旨在改善认知症状的药物占比最高达36.6%,其次是小分子药物试验(35.1%),以及免疫疗法(18%)。
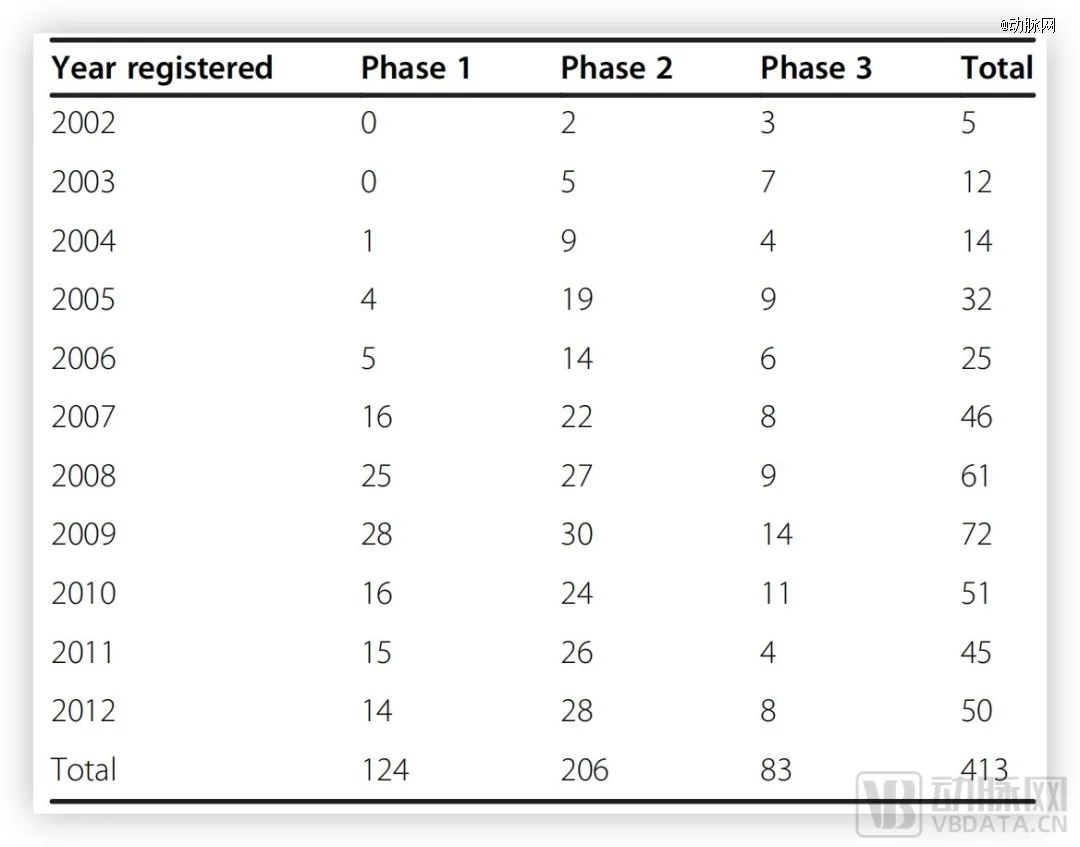
2022年~2012年AD药物临床试验概述,数据源于Clinicaltrials
在这长达10年的跨度中,从1期走向2期的项目仅有21个,流失率为72%;从2期走到3期的项目仅有14个,流失率高达92%;仅有一款药物(Memantine)突破3期,获得FDA批准上市。总体来看,10年间共有244项药物进行了临床试验,即使排除当时尚处于3期的14个项目,整体成功率仅为0.4%,失败率高达99.6%。
即便是最近10年,AD药物研发同样是一个风险极高的行为,即便是跨国药企,也栽了不少跟头。
强生与辉瑞联合研发的Bapineuzumab及罗氏Gantenerumab,分别于2012年和2014年止步于临床试验3期;2016年,被称为“阿尔茨海默*药”的LMTX同样在3期临床试验时以失败告终;2018年,礼来和阿斯利康宣布停止口服抑制剂Lanabecestat的3期临床试验。
之后罗氏重启Gantenerumab,在两项临床试验中尝试使用更高剂量的抗体。这两项试验在30个国家招募了近2000名因阿尔茨海默症而患有轻度认知障碍或轻度痴呆的患者,在用药27个月之后,并未显示临床终点达到统计学差异,前景暗淡。
据美国药品研究与制造企业协会的数据显示,从1998年~2017年,共有约146项阿尔茨海默病药物临床试验失败,多家大型药企自2000年以来总投入约6000亿美元。
数十年时间,数千亿资金的投入,数千项试验的展开,仍无一治愈疗法,这就是被称为“黑洞”的阿尔茨海默药物研发的现状。
造成此种现象的原因在于阿尔茨海默病的发病机理非常复杂,截至目前,医学界仍未完全破解其发病原因。多年来,阿尔茨海默病药物研发主要基于一个最被认可的“假说”——Aβ沉积。除此以外,新的研究也出现了不少新假说,如炎症反应、线粒体、溶酶体异常等,对应也出现一些的靶点研究,甚至“减肥神药”司美格鲁肽也在向AD领域拓展适应症。
Lecanemab的获批,给了行业希望,证明阿尔茨海默这条路并非一黑到底,在众多药企的持续努力之下,已然闪现出一丝光明。
02 成功源于坚持
尽管多家跨国药企都在AD上吃过苦头,但这并未让他们放弃多年的坚持。
以Lecanemab的诞生为例,30多年前,Lars Lannfelt首次在AD患者身上发现产生β淀粉样蛋白的基因突变;20年前,Lannfelt创立BioArctic;11年前,Osswald和几位专家加入仅有几十人的BioArctic参与AD药物开发;之后BioArctic与卫材达成合作,卫材又与渤健合作参与研发和商业化,才有今日Lecanemab的获批。
Lecanemab的成功离不开众多从业者长期的坚守,并且如此坚持的人并不在少数。
11月初,礼来的首席科学官Daniel Skovronsky博士“极度乐观”地表示,阿尔茨海默病治疗的重大突破即将到来,礼来正在研发的这种药物将可能成为下一个类似减肥神药“GLP-1”的热点。
让Skovronsky博士如此乐观的或许是礼来于今年二季度向FDA递交的Donanemab完全获批申请有望在年底获得审评结果,以及自己多年来的坚持看到了希望的曙光。早在1998年,还在宾夕法尼亚大学医学院的Skovronsky就发表了AD领域的研究论文。之后还创办过一家开发阿尔茨海默病患者诊断试剂的Avid radiopharmacticals公司。Skovronsky博士也多次公开表示研究阿尔茨海默病是其毕生的工作。
阿尔茨海默病作为当今最难攻克的疾病之一,在乙酰胆碱酯酶和NMDAR之后已经多年没有新靶点的创新药被成功研发。这期间,一些药企被迫暂时放弃。
2017年,默沙东Verubecestat的3期临床宣告失败,之后在AD药物研发竞赛中逐渐退出;同年,GSK也关闭了以AD、帕金森和各类疼痛疾病为主要研究领域的中国研发中心。辉瑞也于2018年宣布结束所有AD和帕金森等CNS在研项目;2019年,安进退出CNS领域。
另一方面,尽管研发难度极大风险极高,但药企一旦看到机会也会毫不犹豫地出手。
BMS与Prothena达成研发合作,获得了其在研Tau蛋白抗体疗法PRX005的美国开发权益;艾伯维以最高10亿美元的价格收购了主推阿尔茨海默症药物管线SDI-118的Syndesi Therapeutics;GSK与Alector达成合作开发AL001,这是一款潜在FIC单克隆抗体疗法。通过sortilin受体蛋白提高PGRN水平,达到治疗效果;此外,默沙东与Cerevance也达成11亿美元的合作,利用后者的NETSseq技术平台筛选新的AD药物靶点。
正是有了药企和从业者多年来的坚持不放弃,才有了行业全面开花的契机。
03 陆续获批,行业迎来百家争鸣
沉寂20年后,AD药物逐渐迎来收获期。
渤健的Aducanumab于2021年获FDA加速批准上市,成为*获批上市靶向Aβ疗法药物。尽管因疗效和安全性受到质疑,商业化表现不佳,渤健甚至还撤回了欧洲的上市申请,但不可否认的是,这款看似失败的药物为行业吹响了冲锋的号角。
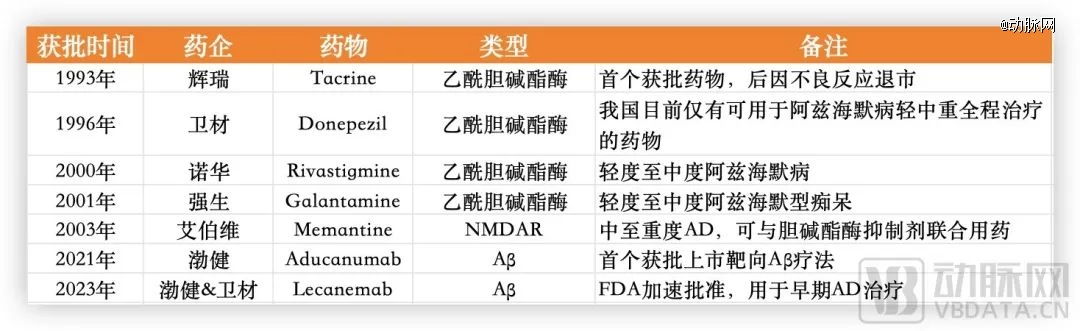
已获批的AD药物,数据源于公开信息整理
礼来寄予厚望的靶向N3pG(Aβ亚型)单抗Donanemab,继去年底在与Aducanumab头对头试验中的优异表现后,在今年7月公布的TRAILBLAZER-ALZ 2的3期临床研究中也取得可喜结果。
研究结果显示Donanemab显著减缓了早期症状性AD患者的认知和功能的下降;同时亚组分析结果表明,处于疾病早期阶段的受试者获益更大,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了60%。相较于其他同类药物,TRAILBLAZER-ALZ 2研究纳入的患者疾病状态更深,这意味着相应患者群体范围也更广。
鉴于3期临床的积极结果,礼来已经向全球市场提交了上市申请,并于10月底在国内申报上市。
除此以外,礼来另一款AD药物Remternetug也处于临床3期状态。Remternetug是礼来研发的新一代N3pG单抗,同样靶向N3pG的淀粉样蛋白亚型,为Donanemab的升级版,目前正在开展治疗早期AD的国际多中心(含中国)3期临床试验,其中国家药监局已授予其突破性疗法认定。
不仅仅是礼来,其他跨国药企的药物在临床试验中也展现出良好结果。
在10月底刚结束的2023年阿尔茨海默病临床试验(CTAD)会议上,多家药企公布了他们最新临床试验的结果。
卫材在大会上公布了其获批新药Lecanemab的临床数据。在评估认知水平的ADAS-Cog14评分上,tau蛋白水平低的患者亚群的评分改变速度减缓52%,是整个患者群(26%)的两倍,而tau蛋白水平为中高等的患者亚群的数值只有9%。在检测日常生活能力的ADCS MCI-ADL评分上,tau蛋白水平低的患者亚群的症状恶化速度延缓88%,而整个患者群体这一数值为37%,中高tau蛋白水平患者亚群的数值为13%。Lecanemab在多项认知水平和日常生活功能评估指标方面表现出明显的改善。
此外,卫材还分享了一项关于Lecanemab用皮下注射剂比静脉注射剂更有优势的研究。目前,Lecanemab获批的是静脉注射剂,而皮下注射的方式在清除淀粉样蛋白方面更为有效,相较于静脉注射,它清除淀粉样蛋白的效率高出约14%。同时,皮下注射所用时间大大少于静脉注射。
渤健也在大会上宣布了其在研tau蛋白靶向反义寡核苷酸(ASO)疗法BIIB080,在用于治疗轻度阿尔茨海默症的1b期临床试验获得优异结果,并已开启CELIA临床2期试验,以进一步研究该药物的疗效与安全性。2期试验预计招募735人,并计划在2026年12月完成。
Alnylam公司的RNAi疗法ALN-APP同样在治疗AD的1期临床中取得了积极中期结果,数据显示单剂量ALN-APP的持续药效可长达10个月,与AD相关的淀粉样蛋白片段Aβ42和Aβ40显著降低。目前,ALN-APP的1b期临床已经首先在加拿大启动。
此外,Cognito的声光疗法同样在2期临床试验中获得积极结果,AD患者在接受治疗超过18个月后,大脑萎缩速度和日常自理能力下降速度减缓。在治疗周期内,声光疗法并没有引起靶向淀粉样蛋白(Aβ)的单克隆抗体通常会导致的淀粉样蛋白相关的成像异常。值得一提的是,该疗法不但可以单独使用,还可与抗Aβ单克隆抗体联用。
美国药品研究与制造企业协会的数据显示,从1998年~2021年,全球共有约85种新AD药物投入研发,随着新靶点的出现以及研究的深入,未来AD药物将呈现出厚积薄发的态势。
04 药物未动、检测先行
AD药物研发竞赛也推动了AD诊断的发展。
随着Aducanumab和Lecanemab的获批,阿尔茨海默症的筛查诊断,成为众多临床检测企业争相发力的方向。过去,阿尔茨海默症长期处于无药可用的状态,AD早筛并没有太多临床价值,因此未受重视。
目前,AD临床诊断的金标准是神经影像学检查和脑脊液CSF分析,然而随着更多生物标记物的发现和检测的进步,使得检测患者血液中与阿尔茨海默症相关的分析物成为可能。同时,血液检测侵入性小、成本低的特点让其在大规模、潜在无症状的人群中能够大面积展开筛查。
今年7月,丹纳赫旗下的贝克曼库尔特与日本医学检测老牌龙头Fujirebio合作,共同开发用血液检测的方式筛查阿尔茨海默症。Fujirebio开发的基于脑脊液的Gβ-淀粉样蛋白比率(1-42/1-40)检验,获得了FDA的新分类,并且已经被欧美医生用于AD检查。一旦开发出基于血液的Gβ-淀粉样蛋白比率检测方法,无疑将进一步加速AD血液筛查的市场渗透。
此外,罗氏也与礼来合作开发用于AD早期筛查的血液检测Elecsys Amyloid Plasma Panel(EAPP),EAPP通过测量血液中的磷酸化Tau181(pTau181)蛋白和载脂蛋白4(APOE4)来判断AD的发病风险,前者的升高通常发生在AD早期阶段,而后者则是AD最常见的遗传风险因素。
尽管目前还没有针对AD血液检测的项目获FDA批准,但一些企业如Quest、C2N Diagnostics和Quanterix已经开始用LDT方式提供检测服务。
Quest在7月底推出了AD血液检测项目AD-Detect Test,该项目使用质谱法测量血液中淀粉样β(Aβ)42/40的比值来评估大脑中出现阿尔茨海默病特征性淀粉样病变的可能性,售价399美元。
与Quest的检测一样,C2N的PrecivityAD和PrecivityAD2检测也使用质量规格来评估脑淀粉样病变的可能性。PrecivityAD检测的模型包括Aβ42/40比率、载脂蛋白E蛋白形式测量值和患者年龄。PrecivityAD2检验包括这些因素以及磷酸化-tau 217与非磷酸化-tau 217的比率。Quanterix的LucentAD LDT检测血液中p-tau 181的水平,以评估脑淀粉样病理,作为排除该疾病的检测方法。
Quest检测产品的上线引发了一定的争议,一些专家担心Quest的检测会引起大量的假阳性,这些假阳性患者的就诊需求会让本已紧缺的阿尔茨海默症医生专家资源更加紧缺。
尽管AD早筛正迎来一个新的风口,但从Quest AD-Detect Test上市后的反应来看,AD早筛的商业化道路才刚起步,后续还有很多问题需要去解决。
05 国内多家企业布局
面对阿尔茨海默症这个蓝海市场,国内企业也在积极布局。
目前国内药企的研发主要集中在胆碱酯酶和NMDA受体,多处于2期临床阶段。针对Aβ靶点,仅有恒瑞医药的SHR-1707等几款药物在研。SHR-1707是国内*申报临床的Aβ抗体,目前处于1b期临床试验阶段。恒瑞在投资者平台中表示其最新研究结果整体表现符合预期。
先声药业引入的Varoglutamstat,则是基于Aβ上游的谷氨酰胺环化酶(QPCT),该酶在AD患者大脑中的含量远高于健康人,能催化N3pE淀粉样蛋白的形成。这是AD患者脑中特有的Aβ肽的一种*神经毒性的变体,能引发AD患者的认知能力下降。目前,该药获CDE批准在中国进入临床试验,目前处于2期临床阶段。
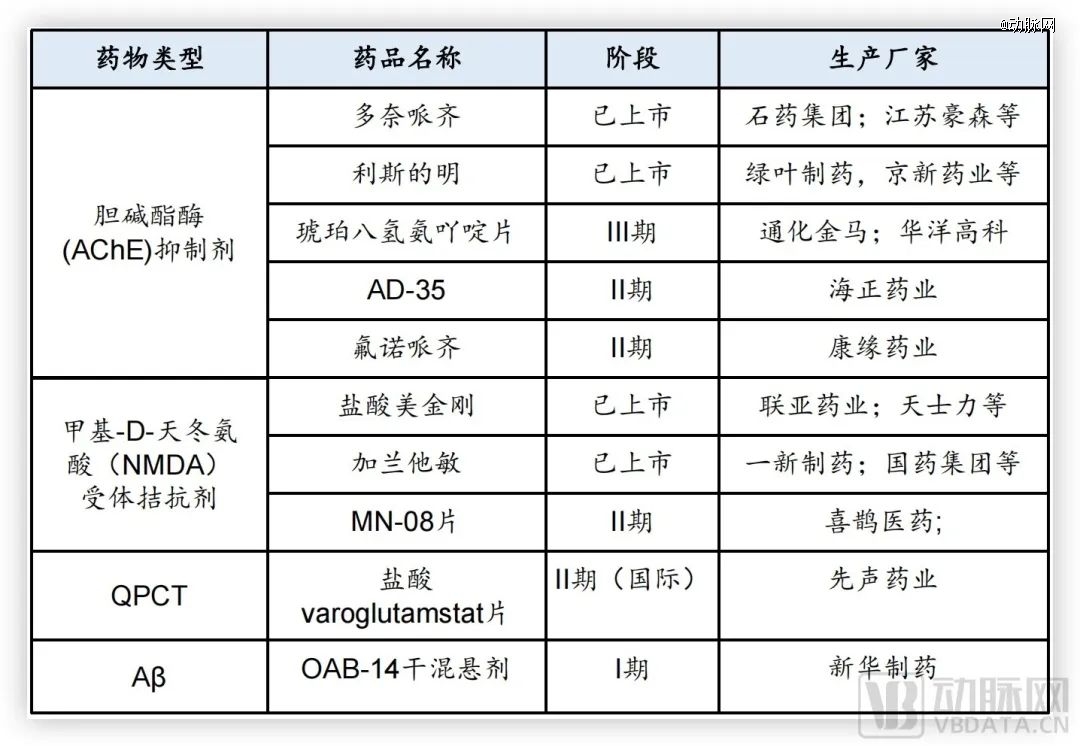
国内部分AD药物研发进度,图片源于华福证券研究所
整体而言,目前进展较快的国产药物包括先声药业的Varoglutamstat、海正药业的AD-35、康缘药业的氟诺哌齐以及恒瑞医药的SHR-1707等。除了药物以外,利用近红外光技术治疗阿尔茨海默症也成为一种选择,慧创医疗在2019年申请了国内最早的近红外光治疗退行性疾病的原理专利。通过三年多的创新研发,光疗AD产品目前已进入国家创新器械的特别审查程序。
8月末,中成药企业通化金马宣布完成了用于AD治疗的琥珀八氢氨吖啶片3期临床试验盲态数据审核。消息一出,二级市场一片欢腾。在此后的交易日中,通化金马的股价8次冲上涨停板。
二级市场的疯狂某种程度上也代表了社会对于AD领域突破的渴望,尽管国内AD药物的研发尚需时日,但在AD早筛领域,国内企业却实现了多个从0到1的突破。包括永和阳光、先通医药、医未医疗以及豪思生物等企业,都有相关产品问世。过去2年间有多家相关企业完成融资,启明创投、国科嘉和、金沙江创投等专业机构纷纷入局。
随着Lecanemab的获批以及被有条件纳入Medicare,市场对于AD药物的商业化前景充满期待。同时,多项研发的深入也让AD药物的研发探索出新方向,包括国内卓凯生物的基于AD遗忘机制的全球*Rac1靶向药目前已处于临床2期阶段,以及恒瑞的自主研发抗Aβ单克隆抗体SHR-1707等。
新药的获批以及多个在研药品表现出的优异临床结果,无疑展现出AD药物的研发进入到百家争鸣的时代。据《中国阿尔茨海默病报告2021》显示,我国2015年AD患者的总治疗费用约为1.2万亿元,预计2050年将增长至约13.2万亿元。庞大的市场需求尚未被满足。再给AD药物一点时间,希望就在前方!