尽管已陷入内卷狂潮,但HER2仍然是当下最热门靶点之一,也是众多药企攻克的核心靶点。
曲妥珠单抗,是*个以HER2为靶点的靶向药,*个用于治疗实体瘤的人源化单克隆抗体,也是*个成功以生物标志物为指导的抗癌药物。
它开启了抗癌药物开发新时代,对我们了解其分子病理生理学和药物作用机制有着重要作用。
在过去的几十年里,除曲妥珠单抗外,研究人员还挖掘了一些新的HER2靶向疗法,主要有三大类:小分子酪氨酸激酶抑制剂(TKI)、单克隆抗体和抗体药物偶联物。
本文以曲妥珠单抗的开发为切入点,深度分析HER2靶向治疗疗效,以及HER2阳性检测在过去25年的发展历程。
01 曲妥珠单抗
1987年,“赫赛汀之父”Dennis Slamon等人发现,HER2基因产物可能作为一种生长因子受体,在乳腺癌的发病机制中发挥作用,其配体的识别和特异性拮抗剂的开发可能具有重要的治疗意义。
后来,基因泰克实验室开发了一种小鼠单克隆抗体,该抗体对HER2扩增的人乳腺癌细胞系具有选择性生长抑制作用。
此外,使用过表达HER2的人乳腺癌细胞进行的肿瘤异种移植模型的体内研究表明,4D5抗体表现出显著的生长抑制作用。
然而,如果小鼠单克隆抗体用于人类,它可能导致免疫遗传反应,这可能会影响疗效和安全性。
基于分子移植的一种新技术,基因泰克研究人员使将小鼠抗体改变为人源化版本成为可能。这种人源化版本的4D5抗体在阻断表达SK-BR-3的人乳腺癌细胞的HER2的增殖方面表现出与小鼠版本相似的效力。
在异种移植模型中,人源化抗体显示出对人乳腺肿瘤表现出明显的生长抑制作用过度表达HER2。
此外,它被证明在支持针对SK-BR-3细胞的免疫抗体依赖性细胞毒性(ADCC)方面更有效,随后被证明是单克隆抗体治疗作用机制的重要组成部分。
由自然杀伤(NK)细胞介导的ADCC可能是曲妥珠单抗与其抗肿瘤作用相关的主要作用机制。
临床前研究的另一个重要发现是一种细胞毒性药物与曲妥珠单抗联合使用的附加效应,这后来对临床试验的设计产生了重大影响。针对HER2蛋白胞外结构域的4D5抗体的人源化版本现在已经准备好进行临床开发。
02 转移性乳腺癌
临床前研究表明,HER2过表达水平与曲妥珠单抗对肿瘤细胞生长的抑制之间存在联系,这对曲妥珠单抗进入临床开发至关重要。
为了选择合适的试验患者群体,基因泰克开发了一种半定量免疫组化(IHC)检测方法——CTA,可检测肿瘤组织中HER2的表达水平。
1992年,I期临床试验启动,目的是研究曲妥珠单抗的安全性、*耐受剂量和药代动力学。
在随后的一年中,进入了II期临床开发。该项目包括三个试验,曲妥珠单抗可以作为单药治疗或与顺铂联合使用。
在第二阶段的项目中,我们从今天的IHC检测中了解到了HER2过表达的标准化评分标准。表1显示了fda批准的HerceptTest检测的乳腺癌细胞膜染色强度评分标准。

然而,值得注意的是,在曲妥珠单抗治疗转移性乳腺癌的开发过程中,HER2阳性的标准是IHC2+或IHC3+。
在一项II期试验中,曲妥珠单抗作为单药治疗于222例her2后转移性乳房患者癌症,试验中所有患者的客观应答率(ORR)为15%。
然而,亚组分析显示,IHC3+评分的患者的ORR高于IHC2+评分的患者。
1995年,一项III期临床试验启动,以评估曲妥珠单抗联合化疗的疗效,即469例转移性HER2阳性乳腺癌患者随机接受曲妥珠单抗加蒽环类和环磷酰胺或紫杉醇治疗。
该试验显示,在化疗中加入曲妥珠单抗会导致ORR的增加(50%Us。32%;P<0.001),反应持续时间较长(中位数为9.1 vs 6.1个月;P<为0.001),中位生存期较长。
与II期临床试验类似,与IHC2+患者相比,IHC3+评分的患者从曲妥珠单抗治疗中获益*。
在进行III期试验期间,人们意识到CTA太复杂,可能不够强大,无法在一般病理实验室中更广泛地使用。
为了简化检测方法并使其更加可靠,基因泰克开始与诊断公司Dako合作。
03 辅助阳性乳腺癌
在曲妥珠单抗被批准用于治疗转移性HER2阳性乳腺癌症几年后,国家癌症赞助的辅助临床试验研究所成立。
这两项试验由国家手术辅助乳房和肠道项目(NSABP)和北中央癌症治疗组(NCCTG)领导。
在NSABP B-31试验中,HER2阳性早期乳腺癌患者随机接受阿霉素和环磷酰胺,然后接受紫杉醇或相同的化疗方案加曲妥珠单抗,为期一年。
NCCTGN9831试验的设计略有不同,接受曲妥珠单抗治疗的患者组被分为B组和C组。在B组,曲妥珠单抗在12周紫杉醇治疗后给予一年,而C组曲妥珠单抗与曲妥珠单抗同时给予12周,随后40周曲妥珠单抗单药治疗。
当辅助试验建立时,HER2阳性的标准从IHC2+或IHC3+改为使用荧光原位杂交(FISH)的IHC3+或HER2扩增(HER2/HEN17≥2.0)。
2006年11月,基于NSABP B-31和NCCTG N9831试验的阳性结果,曲妥珠单抗被FDA批准用于早期her2过表达、淋巴结阳性乳腺癌患者的辅助治疗,作为包含阿霉素、环磷酰胺和紫杉醇的方案的一部分。
其他使用曲妥珠单抗的大型辅助试验,如HERA试验和该试验由乳腺癌国际研究小组进行的研究,在DSF的主要终点方面也显示出了类似的阳性结果。
2014年,对NSABP B-31和NCCTG N9831试验进行了最终生存分析,中位随访时间为8.4年。该分析结果显示,曲妥珠单抗与化疗联合治疗可使总生存率(OS)相对改善37%(HR0.63;P<0.001),10年生存率从75.2提高到84.0%。
04 胃癌
早在1986年,就有胃癌中HER2的HER2扩增和过表达的报道。随后,一些研究证实了这些发现,其中一些表明HER2阳性是胃癌患者的阴性预后标志物。
曲妥珠单抗在不同胃癌模型中的不同临床前和体内外研究的阳性结果,以及少数阳性临床病例研究,推动了临床III期试验。
然而,由于乳腺癌和胃癌在肿瘤生物学上存在显著差异,特别是在肿瘤的异质性方面,在试验开始前,对高力测试的评分标准进行了更改,以选择正确的患者群体。表2显示了fda批准的胃和胃食管连接癌的细胞膜染色强度评分标准。

在曲妥珠单抗治疗胃癌(ToGA)试验中,594例her2阳性的胃或胃食管交界癌患者随机接受卡培他滨加顺铂或氟尿嘧啶加顺铂和曲妥珠单抗治疗。HER2阳性定义为IHC3+,根据hercep检测评分标准,或HISHHER2扩增(HER2/ CEN17≥2)。
然而,几乎所有纳入的患者都进行了IHC和FISH检测。在ToGA试验中,主要疗效终点为OS,化疗与曲妥珠单抗联合治疗优于单独化疗。中位OS从11.1个月增加到13.8个月(HR,0.74;P=0.0046)。
一项预先计划的探索性分析检查了不同HER2 IHC评分类别的疗效,结果显示曲妥珠单抗的生存获益依赖于HER2过表达水平。生存获益*的单一患者亚组是IHC3+亚组。
在这里,与单独化疗相比,曲妥珠单抗加入化疗后的中位OS增加到17.9个月,OS为12.3个月。
在2010年11月,基于ToGA试验的结果,FDA批准曲妥珠单抗用于治疗HER2过表达的转移性胃或胃食管交界处腺癌。同时,随着曲妥珠单抗的批准,HercepTest和HER2鱼类药物Dx(Dako)检测获得批准,这两种方法都被用于ToGA试验的患者选择。
05 其他HER2靶向治疗
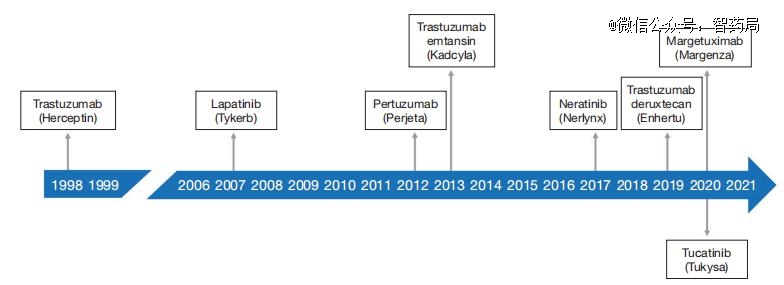
自曲妥珠单抗获得批准以来,其他几种HER2靶向治疗已获得FDA、EMA和其他监管机构的批准。
如下图所示,这些药物已被批准用于多种适应症。根据其主要的作用机制进行分组,简要讨论个别药物。

1.单克隆抗体
单克隆抗体的作用机制是通过与HER2的胞外结构域结合来改变酪氨酸激酶(TK)信号通路,更重要的是,可能是通过NK细胞介导的ADCC。
除了曲妥珠单抗外,另外两种针对单克隆抗体的HER2也获得了监管部门的批准,分别是帕妥珠单抗和马格妥昔单抗。
帕妥珠单抗
帕妥珠单抗是一种人源化单克隆抗体,针对HER2蛋白胞外结构域的亚结构域II,而曲妥珠单抗则与亚结构域IV结合。
帕妥珠单抗特异性地阻止HER2与HER家族其他成员的异二聚,包括表皮生长因子受体[EGFR(HER1)]、HER3和HER4,从而阻断下游信号传导。
马格妥昔单抗
马吉妥昔单抗是一种单克隆抗体,可结合到HER2的胞外结构域。与曲妥珠单抗相比,马格妥昔单抗的Fc受体亲和力发生了改变,这通过NK细胞激活增加了抗体依赖的细胞毒性。
2.酪氨酸激酶抑制剂(TKI)
TKIs‘是一种穿过细胞膜并抑制HER2受体的细胞内TK活性的小分子。*个获得FDA批准的TKI是拉帕替尼,其次是奈拉替尼和图卡替尼。
拉帕替尼
拉帕替尼是一种口服的针对her1及her2双靶点的小分子酪氨酸激酶抑制剂。酪氨酸激酶抑制剂顾名思义,就是能够抑制酪氨酸激酶活性的物质。
尼拉替尼
奈拉替尼是一种多激酶抑制剂,可不可逆地与EGFR、HER2和HER4的TK结构域结合。
图卡替尼
图卡替尼是一种口服酪氨酸激酶抑制剂(tki),对HER2和HER3的TK结构域均具有双重抑制作用。
3.抗体药物偶联物
到目前为止,两种针对HER2的ADC已获得FDA的监管批准,均以曲妥珠单抗作为载体抗体,即曲妥珠单抗恩坦辛(T-DM1,罗氏/基因泰克)和曲妥珠单抗德鲁替康(Enhertu,*三共/阿斯利康)。
曲妥珠单抗恩坦辛
曲妥珠单抗恩坦辛(T-DM1)是*个被FDA监管批准的HER2靶向ADC。细胞毒性药物DM1是一种梅坦辛衍生物,通过一个稳定的连接物与曲妥珠单抗相连。
DM1是一种微管抑制剂,可与微管蛋白结合,破坏细胞内的微管网络,导致细胞周期阻滞和凋亡。
曲妥珠单抗德鲁替康
曲妥珠单抗德鲁替康(T-DXd)是另一种HER2靶向ADC,其中细胞毒性有效载荷是德鲁替康(DXd),这是一种拓扑异构酶I抑制剂,通过一种特定的连接剂与曲妥珠单抗连接。
在受体内化后,该连接体在细胞内被溶酶体酶裂解,DXd分子被释放,导致DNA损伤和细胞凋亡死亡。
T-DXd的*个适应症是HER2术后转移性乳腺癌。
06 说在最后
肿瘤是一个动态的实体,当患者接受包括HER2靶向治疗在内的抗癌药物治疗时,就会产生耐药性。
这说明,需要在更好地了解耐药性和肿瘤脆弱性机制的基础上开发新的模式。
近期,《自然综述药物发现》上的一篇综述中说到,正在开发几种治疗her2阳性肿瘤的新方法。
这些方法包括与免疫检查点抑制剂、新的单特异性抗体和双特异性抗体、新的adc、TKIs和靶向HER2的疫苗的联合治疗。