2017年,诺华的Kymriah获FDA批准上市,正式揭开细胞疗法赛道的序幕。Grand View Research数据显示,2022年全球细胞治疗市场规模为47.7亿美元,预计2023年至2030年复合年增长率(CAGR)为16.5%。
国内方面,自2023年以来,细胞疗法领域的活跃度明显攀升。2022年Q1申报临床的细胞疗法尚不足10款,2023年Q1共有36款取得临床申报进展。国内药企布局差异化越来越明显,适应症正在向实体瘤、自免领域以及血液肿瘤全面覆盖。
智药局梳理了中国已进入临床阶段的细胞疗法药企的管线布局,如有错处,欢迎指正。
1、下一个“Carvykti”?
传奇生物
传奇生物是金斯瑞旗下公司,成立于2014年,是一家应用其专有技术于自体和异体嵌合抗原受体T细胞疗法开发的综合性细胞治疗平台公司。目前共披露有17项在研产品,主要针对恶性血液肿瘤和实体瘤领域。
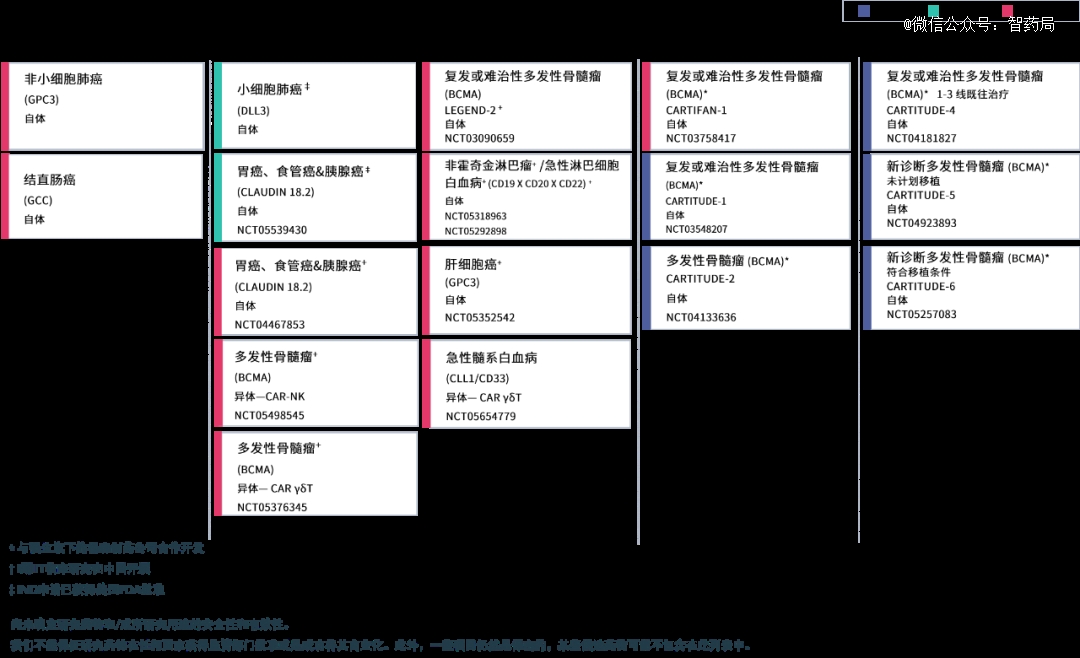
Carvykti(西达基奥仑赛):由传奇生物与强生杨森合作开发,是一种结构差异化的CAR-T细胞疗法。2022年,FDA正式批准Carvykti上市,用于治疗复发性/难治性多发性骨髓瘤,市场表现优秀,2023年H1销售额约为1.89亿美元。
LB1908: 传奇生物开发的一种通过高亲和力vhh抗体选择性靶向claudin 18.2的自体car-t疗法,用于治疗复发性或难治性胃癌、食管癌(包括胃食管连接部)或胰腺癌成人患者。该疗法已经进入剂量递增I期临床试验,表现出了良好的安全性和初步的抗癌活性。
LB2101:一款靶向 GPC-3 的CAR-T疗法。GPC3为癌胚蛋白,在正常组织中不表达或者低表达。LB2101采用scfv结构,同时引入其它机制,能够克服肿瘤微环境(TME)免疫抑制,并在临床前动物试验中展示了强大的肿瘤杀伤作用。
驯鹿生物
驯鹿生物创立于2017年,是一家专注于血液肿瘤细胞类药物和抗体药物开发的企业。拥有五大技术平台:全人源抗体开发平台、免疫细胞药物开发平台、全流程生产及检定技术平台、药理药效平台及临床开发平台。目前10余个管线产品在研,主要聚焦血液肿瘤的自体及通用CAR-T产品开发。
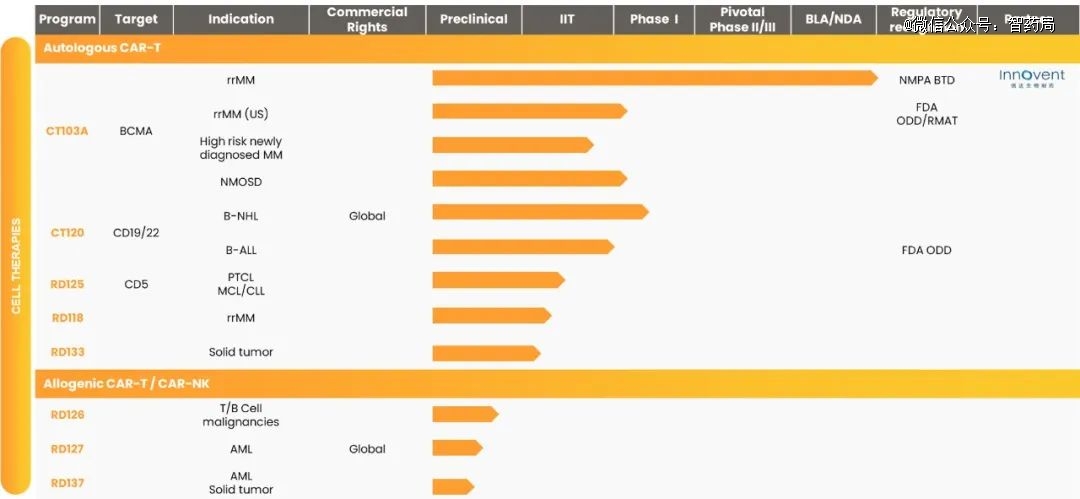
CT103A(福可苏):一款由驯鹿生物与信达生物共同开发及商业化的细胞免疫治疗产品,获NMPA上市批准,用于治疗复发难治多发性骨髓瘤成人患者,并已获得FDA临床批准,用于治疗复发/难治多发性骨髓瘤,是驯鹿生物的*上市产品,也是全球*款商业化全人源CAR-T产品。
CT120:一款由驯鹿生物自主研发的全人源CD19/CD22双靶点CAR-T细胞注射液,已进入临床1期。适应症分别为CD19/CD22阳性的复发/难治B细胞非霍奇金淋巴瘤和复发/难治急性B淋巴细胞白血病,并已获得FDA授予孤儿药认定。
科济生物
科济生物是一家在中国和美国开展业务的生物制药公司,专注于治疗血液系统恶性肿瘤和实体瘤的创新CAR-T细胞疗法。建立了一个全面的 CAR T 细胞研发平台,涵盖靶点发现、创新CAR-T细胞开发、临床试验和商业规模生产。
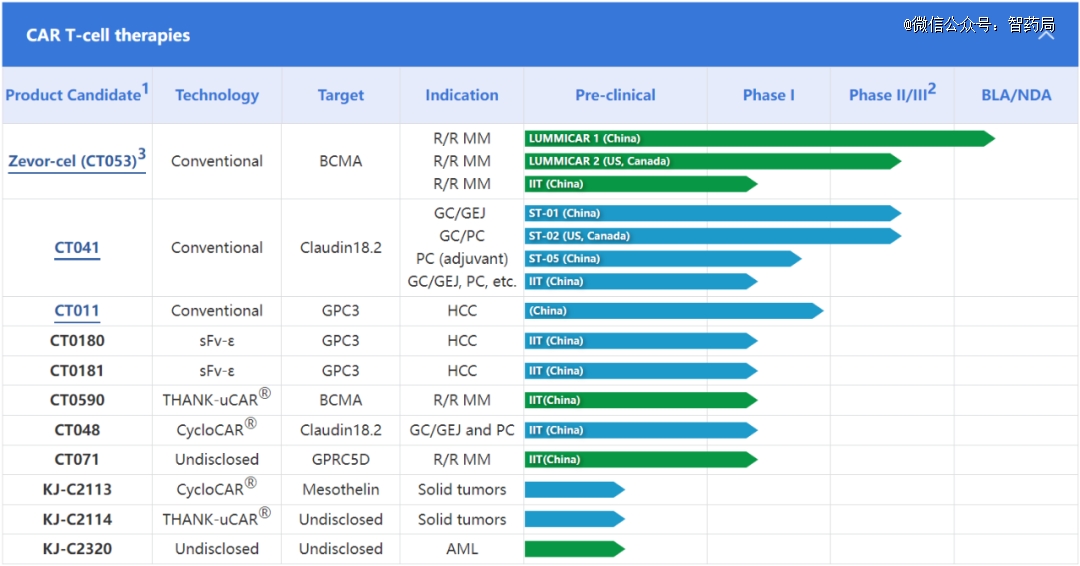
CT053:一款由科济生物研发的,靶向bcma的新型CAR-T细胞疗法,专门用于治疗复发/难治性多发性骨髓瘤(R/R MM)。预计将于2023年和2024年分别在中国和美国获批上市。科济药业还与华东医药就ct053达成在中国大陆地区的商业化合作。
CT041:是一种潜在全球同类首创的、靶向CLDN18.2蛋白质的自体CAR-T细胞候选产品。作为全球*进入关键II期临床的实体瘤CAR-T,CT041治疗3线胃癌的临床数据显著优于现有的化疗、TKI和PD-L1等药物,预计将于2025年在中国和美国获批上市,有望奠定公司实体瘤CAR-T全球龙头地位。
此外,科济药业还有CT011、CT0180、CT018等6款在研药物,均已进入临床1期。
亘喜生物
亘喜生物创立于2017年,是一家面向全球、处于临床阶段的生物制药企业,致力于开发创新、高效的细胞疗法。利用其开创性FasTCAR(大幅缩短CAR-T细胞产品制备周期)和TruUCAR(异体CAR-T细胞产品)技术平台,亘喜生物正在开发多项自体和同种异体的丰富临床阶段癌症及自身免疫性疾病治疗产品管线。
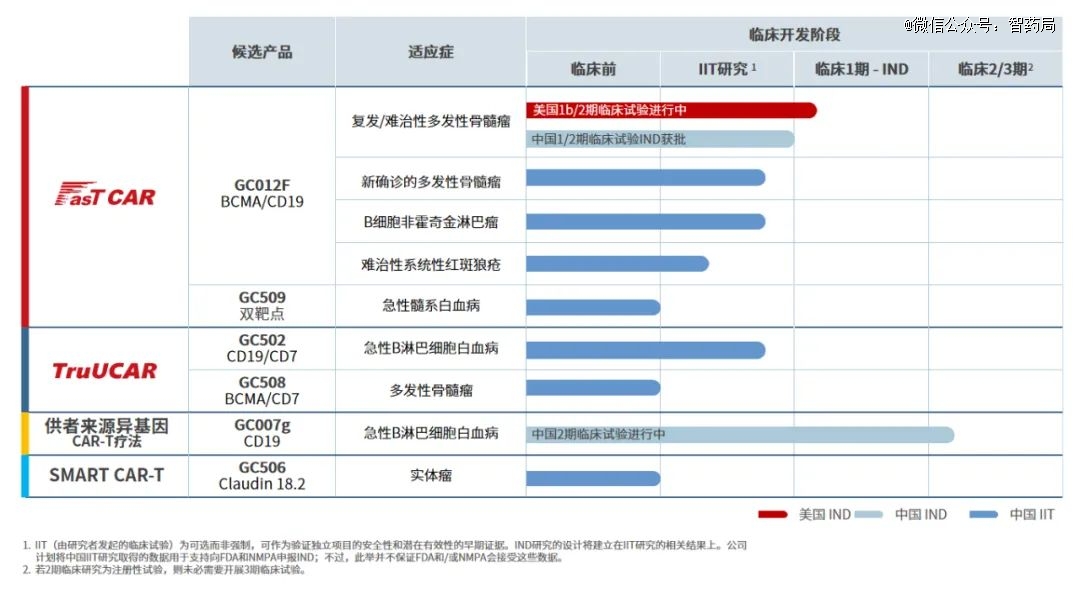
GC007g:一种供者来源靶向CD19 的嵌合抗原受体CAR-T细胞产品,治疗复发难治B急性淋巴细胞白血病,目前正在进行关键的2/3期研究。GC007g运用了携带Beacon标签的CAR-T细胞改造技术。
Beacon标签位于VH和VL之间,或位于VL和跨膜结构域之间,可精确计算体内CAR-T细胞的数量,并在不牺牲疗效的基础上控制CAR-T细胞毒性。
GC012F:一款基于FasTCAR平台开发的BCMA/CD19双靶点CAR-T疗法候选产品。GC012F使用开创性的FasTCAR次日生产技术,*的优势是能将过去传统CAR-T的制备时间从数周缩短到次日完成,得到的FasTCAR-T细胞表型更年轻、扩增能力更强,提升针对肿瘤的杀伤能力。此外,快速生产的模式,可高效降低生产成本。
合源生物
合源生物创立于2018年,是细胞与基因创新技术驱动的新一代生物医药企业,构建以CAR技术平台、iPSCs技术平台以及基因编辑技术平台等为核心的国际化新药研发创新体系。聚焦细胞免疫疗法,覆盖血液肿瘤、实体肿瘤及自身免疫性疾病等非肿瘤疾病领域,共有10余种管线产品。
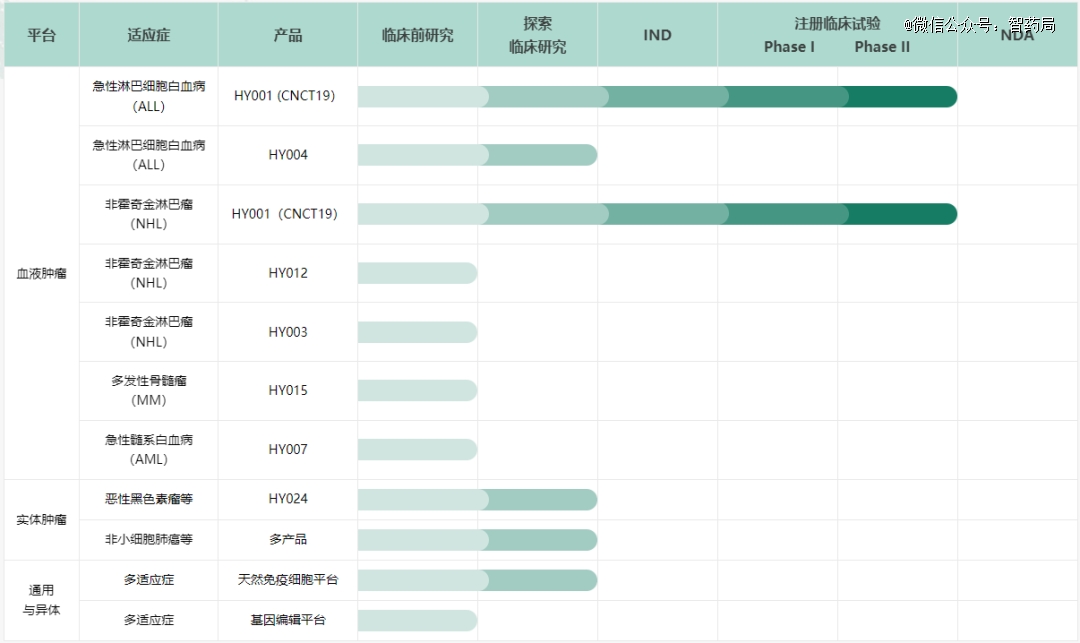
HY001(CNCT19):一款靶向CD19的CAR-T细胞治疗药物产品,其具有独特的CD19 scFv(HI19a)结构。正在中国开展两项2期临床试验,针对的适应症分别为复发或难治性急性淋巴细胞白血病、复发或难治性侵袭性B细胞非霍奇金淋巴瘤。该药已被NMPA纳入突破性治疗药物品种,并被FDA授予孤儿药资格。
该药上市申请(NDA)已于去年12月获得国家药品监督管理局受理,并纳入优先审评,用于治疗成人复发或难治性 B 细胞型急性淋巴细胞白血病(r/r B-ALL),这也是国内*针对该适应症的CAR-T疗法。
原启生物
原启生物成立于2015年,原为原能集团旗下的原能细胞医学技术有限公司Oricell Therapeutics,于2021年5月作为生物创新药研发资产从原能细胞集团分立,更名为原启生物。开始以创新型细胞治疗技术平台为核心,聚焦于肿瘤免疫治疗领域的产品开发。
公司自主创新构建了基于肿瘤细胞免疫治疗的Ori®Ab、Ori®CAR等多个专利技术平台,开发产生了数十个自主创新主要靶向实体瘤的细胞药物和单/双特异性抗体管线。

Ori-C101:原启生物自主开发的靶向GPC3(Glypican-3)的CAR-T疗法,具有独特的信号激活元件Ori,能成倍提升记忆性免疫细胞的扩增效率,有效突破肿瘤微环境中的细胞外基质的物理屏障,抵御肿瘤微环境的免疫抑制,显著增强CAR-T在体内的抗肿瘤活性和持久性,具有更好的防止复发潜力,拟用于治疗晚期肝细胞癌成人患者。
天科雅
天科雅成立于2016年,以工程化T细胞为最终靶向,专注于肿瘤免疫细胞治疗技术的创新性研发和产业化。其拥有美国洛杉矶和北卡以及中国重庆和广州四个中心,在中国和美国均设有研发中心及GMP级别厂房。
建立了TRUST平台(TCR筛选)、CHECK-T细胞改造平台(加载免疫检测点抑制分子)、TURBO-T细胞改造平台(加载肿瘤微环境改造因子)、工业化临床级的病毒转基因载体生产平台、NK细胞平台、临床免疫监控及免疫药效评估6大技术平台。
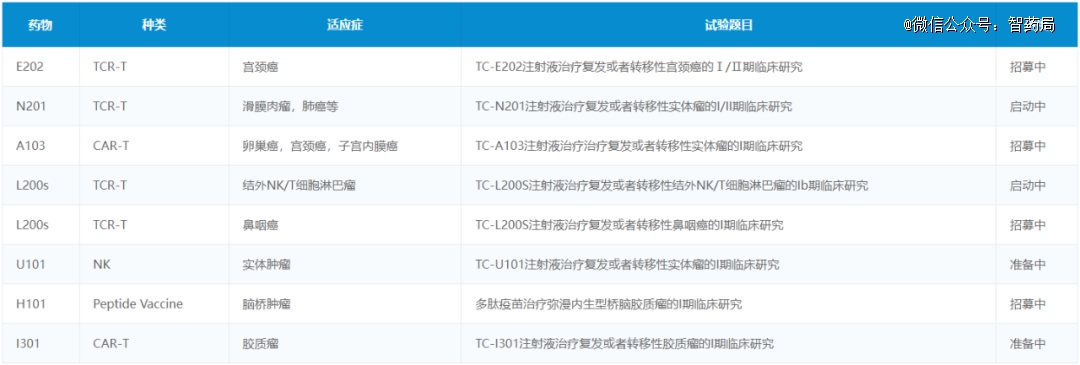
TC-E202:国内*获批治疗宫颈癌的TCR-T候选药物,也是全球*获批的加载抗PD-1抗体的HPV TCR-T临床试验,主要用于治疗HPV阳性复发/转移性宫颈癌。
TC-E202注射液除了改造T细胞上的TCR,还加入了PD-1。这使得经改造的T细胞不仅能够有效激活T细胞发挥肿瘤杀伤作用,还可以分泌出PD-1单链抗体,有效消除肿瘤微环境的抑制。
TC-N201:同E202注射液一样,也是一款免疫抑制分子修饰的TCR-T产品,目前正在进行适应症为LA-A2和NY-ESO-1阳性的既往治疗失败的复发或者转移性实体瘤的临床研究。
西比曼生物
西比曼生物成立于2010年,是一家临床研究阶段的生物制药公司,致力于开发治疗血液和实体肿瘤的免疫细胞治疗产品。2014年正式在美国纳斯克挂牌上市,成为*个在纳斯达克上市的中国细胞治疗生物医药科技公司。公司有肿瘤免疫和干细胞两大平台,并基于专有的平台衍生出多条在研管线。
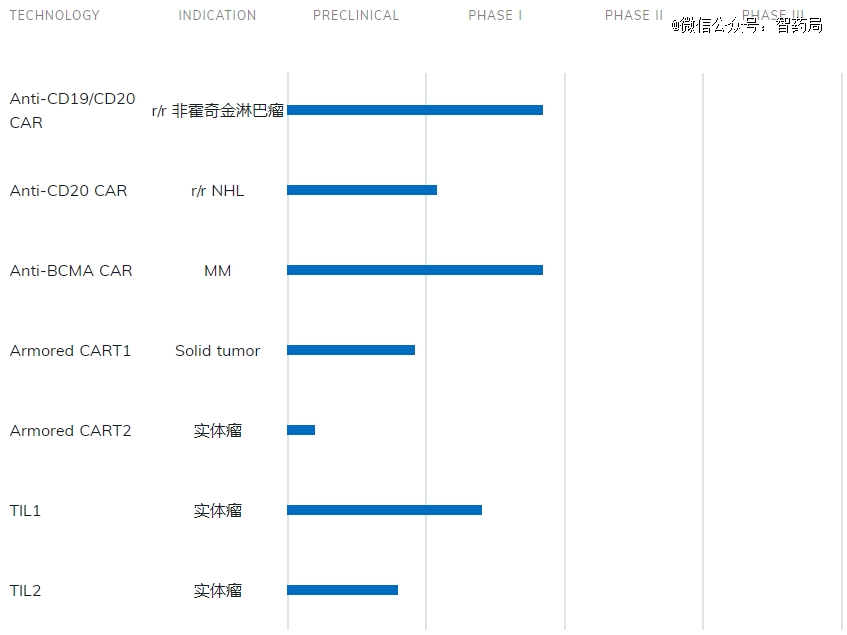
C-CAR039:一款用于治疗复发或难治性B细胞非霍奇金淋巴瘤的新型CD19/CD20双靶点CAR-T细胞治疗产品。在2021年ASCO年会上,西比曼公布了C-CAR039用于治疗r/r B-cell NHL的最新临床数据,总缓解率(ORR)为92.6%,其中完全缓解率(CR)达到85.2%,是潜在的同类*产品。
在美国,C-CAR039正在进行一项治疗复发/难治性弥漫性大B细胞淋巴瘤R/R (DLBCL)患者的Ib期研究。
C-CAR066:一种以CD20抗原为靶点的新型第二代CAR-T。临床前研究表明,与源自Leu16中的scFV的抗CD20 CAR-T(利妥昔单抗和奥妥珠单抗)和与源自scFV FMC63的抗CD19 CAR-T相比,C-CAR066的抗肿瘤活性更强。
今年5月,C-CAR039和C-CAR066除大中华区以外全球其他地区的开发和商业化权,被授权给了强生旗下杨森制药。
药明巨诺
药明巨诺成立于2016年,由Juno和药明康德合资成立,是一家专注于研发、生产及商业化细胞免疫治疗产品。药明巨诺已成功打造了国际*的细胞免疫治疗的综合性产品开发平台,以及涵盖血液肿瘤、实体肿瘤和自身免疫性疾病的细胞免疫治疗产品管线。
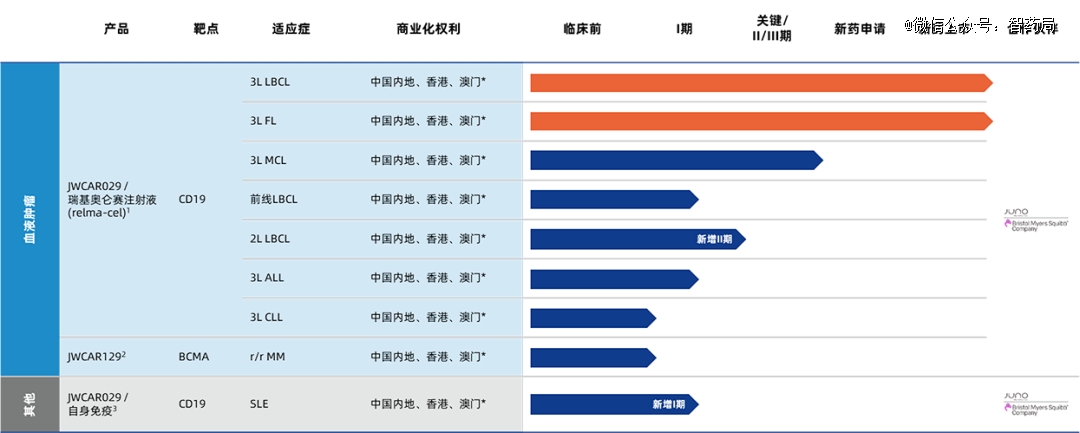
倍诺达®(瑞基奥仑赛注射液):药明巨诺在Juno的CAR-T细胞工艺平台的基础上,自主开发的一款靶向CD19的自体CAR-T细胞免疫治疗产品。于2021年9月1日在我国获批上市,用于治疗经过二线或以上系统性治疗后复发或难治大B细胞淋巴瘤成年患者以及滤泡性淋巴瘤患者,成为中国*获批为1类生物制品的CAR-T产品。
4 月,CDE 官网显示,瑞基奥仑赛一项新适应症获批临床,用于治疗中重度难治性系统性红斑狼疮。这意味着瑞基奥仑赛在血液瘤之外,开始布局市场更加广阔的自身免疫领域。
复兴凯特
复星凯特生物成立于2017年,为复星医药与美国Kite Pharma(吉利德科学旗下公司)的合营企业,深耕肿瘤免疫细胞治疗领域。公司总部位于上海张江高科技园区,10000平方米的CAR-T产业化生产基地已在张江创新药产业基地建成并正式启用。
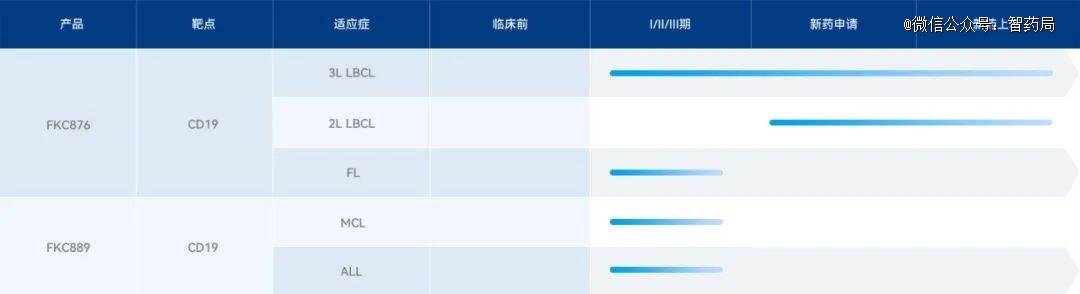
FKC876(阿基仑赛注射液):由复星凯特引进Yescarta这款产品的技术并进行技术转移,然后取得授权在中国进行生产的自体免疫细胞注射剂,是我国*批准上市的细胞治疗药物。由携带CD19 CAR基因的逆转录病毒载体进行基因修饰的自体靶向人CD19嵌合抗原受体T细胞(CAR-T)制备。
FKC889:复星凯特从美国Kite(吉利德旗下)引进Tecartus(brexucabtagene autoleucel)在中国进行产业化、商业化的CAR-T细胞治疗药物,也是复星凯特在血液肿瘤领域的第二款CAR-T细胞治疗药物。FKC889是一种嵌合抗原受体 CAR-T细胞疗法,也是一种利用人体自身免疫系统靶向癌细胞的个体化治疗方法。
波睿达生物
波睿达生物成立于2014年,是一家致力于CAR-T免疫细胞药品研发、中试和申报于一体的制药企业。公司形成了以血液肿瘤CAR-T为主导,病毒感染性疾病CAR-T、实体肿瘤CAR-T和通用CAR-T等多个研发项目并行推进的研发管线布局。
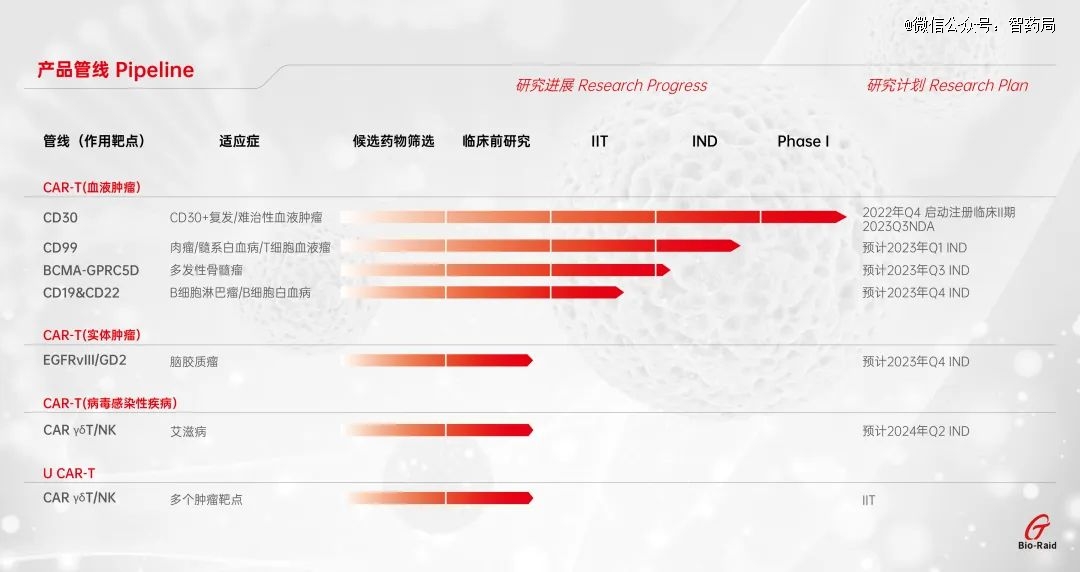
血液肿瘤CAR-T:针对白血病、淋巴瘤、多发性骨髓瘤已拥有CD30、CD19、CD22、CD99、CD20、BCMA等多个成熟靶点,已完成500余例临床试验研究。公司自主研发的CD30 CAR-T细胞治疗产品已获得国家药品监督管理局(NMPA)注册临床默许,该产品也是国内*被批准临床试验默许的以CD30为靶点的CAR-T产品。
实体肿瘤CAR-T:波睿达创新提出溶瘤病毒+CAR-T技术,比单一的CAR-T疗法增加10到30倍的杀瘤效果,该技术专利进入国家实审阶段。
病毒感染性疾病CAR-T:针对感染性HIV已获国家专利授权,PCT专利已在美国、欧洲和日本被进入国家阶段,临床数据显示患者体内的病毒库已处于检测标准之下,未来有望实现功能性治愈。
通用CAR-T:专利进入国家实审阶段。
精准生物
精准生物成立于2016年,以细胞治疗技术为切入点,主营基因与细胞药物开发应用。该公司建立UCAR-T/NK、PrecisionCAR、PRIMECAR、RESCAR、PhiCAR和HyeCAR六大技术平台。
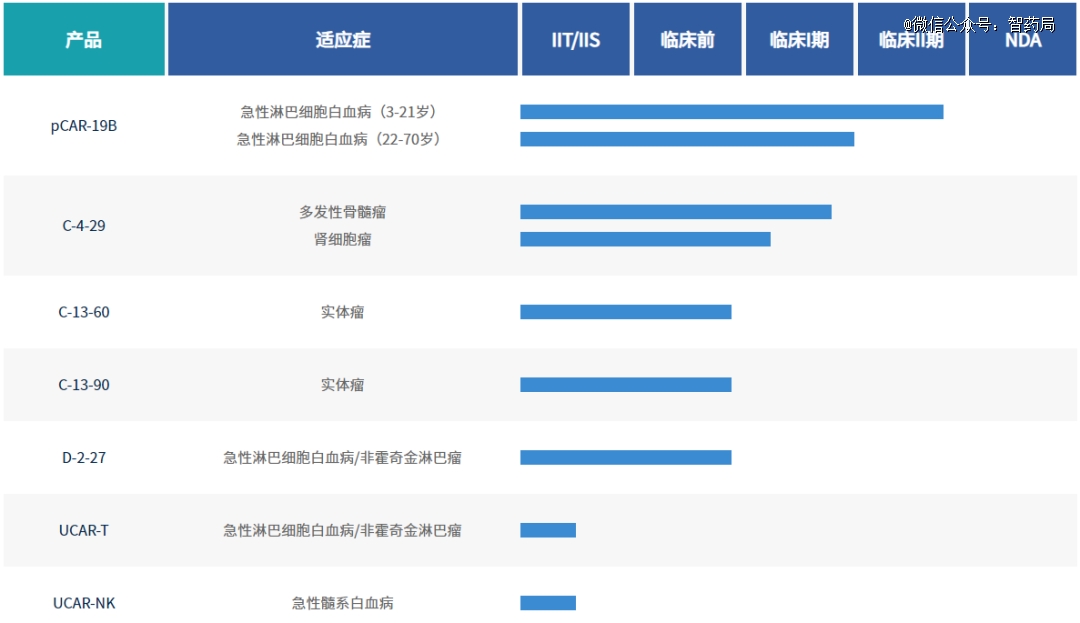
pCAR-19B:由精准生物自主研发的国家一类生物新药,于2019年2月获儿童、青少年B-ALL适应症注册临床默示许可,是国内*针对该适应症进入到Ⅱ期注册临床的CAR-T产品,也是国内*针对该适应症的人源化设计的CAR-T产品。
C-4-29:一款全新的双靶点CAR-T疗法,其靶点组合为国际首创。CD70靶点是精准生物国内首创开发的,兼具血液和实体肿瘤双应用场景的创新靶点,据此开发的C-4-29,可用于治疗患有复发/难治性多发性骨髓瘤(MM)或晚期/转移性肾细胞癌(RCC)患者。目前,这两个适应症均已获批开展临床试验。
易慕峰生物
易慕峰生物,2020年在上海张江启动运营,是一家聚焦实体肿瘤治疗的新型细胞治疗药物研发企业,其基于“将实体瘤化为血液瘤”的临床策略开发了针对肿瘤转移的Peri Cruiser®技术平台。该技术平台通过调控CAR-T细胞在体内的组织分布,避免损伤正常组织,同时保留对原位肿瘤的杀伤,以及能够很好地控制肿瘤转移。
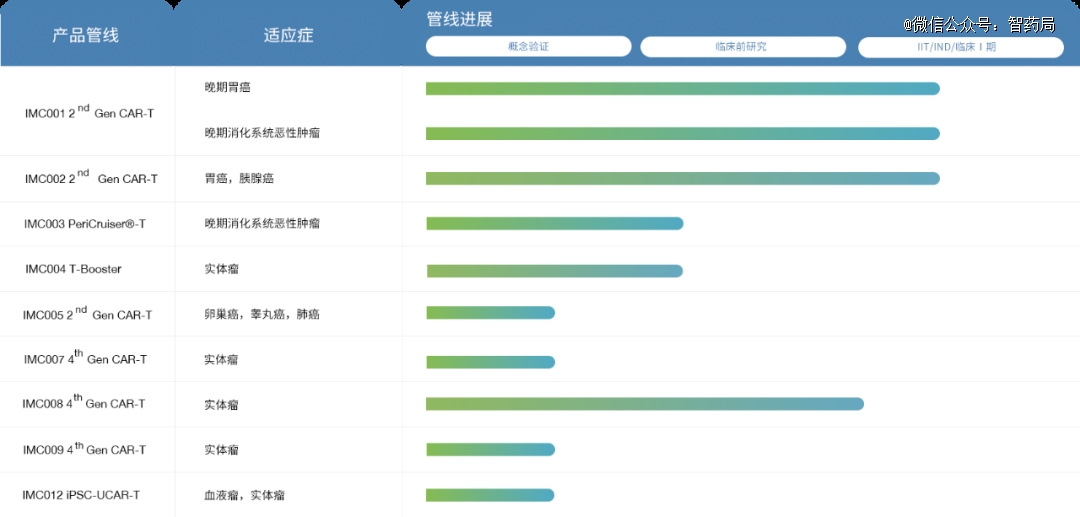
IMC001:一款靶向EpCAM的自体CAR-T产品,目前已进入I期临床阶段。EpCAM在多种上皮细胞来源的肿瘤中高表达,特别在消化系统恶性肿瘤中高表达,且表达均一(表达率90%),是该类晚期肿瘤的有效靶点。同时EpCAM也在循环肿瘤细胞(CTC)上表达,CTC是肿瘤转移的种子,清除CTC有助于阻断肿瘤的远端转移。
IMC002:基于高特异性VHH抗体选择靶向CLDN18.2的自体CAR-T细胞治疗药品,在临床前研究以及IIT研究中展现出良好的安全性和有效性。高特异性的VHH抗体将赋予IMC002更好的耐受性以及潜在更大的临床剂量窗口和适应症范围。
永泰生物
永泰生物是中国一家*的细胞免疫治疗生物医药公司,起源于InnocellUSACorporation在2006年成立的北京永泰,公司专注于T细胞免疫治疗的研发和商业化,主要在研产品包括CAR-T细胞系列及TCR-T细胞系列。
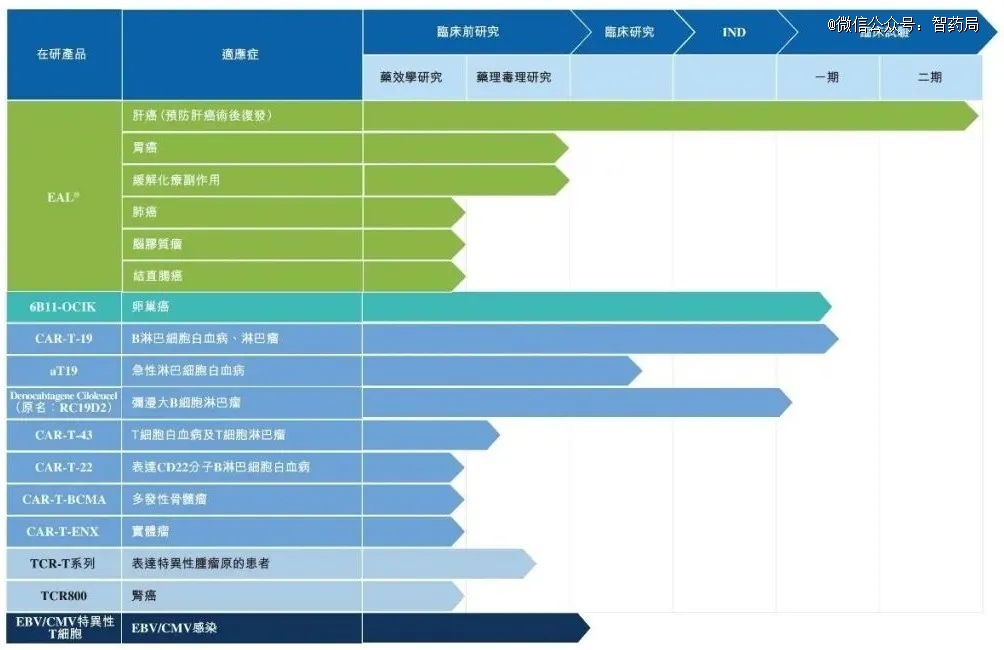
EAL:一款多靶点肿瘤细胞免疫治疗产品,体内药效学试验结果表明,EAL对肿瘤靶细胞具有良好的杀灭作用,且产品整体安全性表现良好。并且多个临床研究显示,EAL®在实体瘤治疗领域具有显著功效。EAL正在进行以预防肝癌术后复发为临床适应症的II期临床试验研究。公司预期将于2024年上市该产品。
6B11-OCIK:一款卵巢癌自体细胞毒性T淋巴细胞的注射液。6B11为北京纬晓利用COC166-9单抗免疫小鼠制备出能模拟卵巢癌相关抗原OC166-9的单克隆抗独特型抗体。
利用6B11可在体外诱导出特异的抗卵巢癌体液免疫和细胞免疫抗体,经过体外培养增殖后(6B11-OCIK注射液)回输给受试者以达到特异杀伤肿瘤细胞的目的。
沙砾生物
沙砾生物成立于2019年,是一家专注于肿瘤免疫细胞治疗,以TIL药物为代表研发管线的创新型医药公司。该公司研发了一系列核心平台,并依托平台开发了一系列下一代基因编辑型TIL药物。

GT101:一款基于患者自体肿瘤浸润淋巴细胞的细胞药物(TIL)。该疗法通过从患者体内获取肿瘤组织并提取TIL,再经过沙砾生物特有的StemTexp®生产平台扩增至10亿量级后输注回患者体内以对抗肿瘤。这也是国内*获批注册临床的TIL药物,目前即将进入关键二期临床试验。
9月8日,沙砾生物宣布完成4亿元人民币的B轮融资。根据新闻稿,本轮融资将用于支持其肿瘤浸润淋巴细胞(TIL)疗法管线的开发,包括GT101的关键临床试验以及多项下一代基因编辑型TIL管线的开发。
艺妙神州
艺妙神州成立于2015年,致力于将CAR-T技术和基因细胞药物应用于恶性肿瘤治疗。研发管线覆盖淋巴瘤、白血病、骨髓瘤等血液肿瘤和肝癌、结直肠癌、胃癌、胰腺癌等实体肿瘤。目前已经有两个产品成功(四个适应症)进入到了临床阶段。
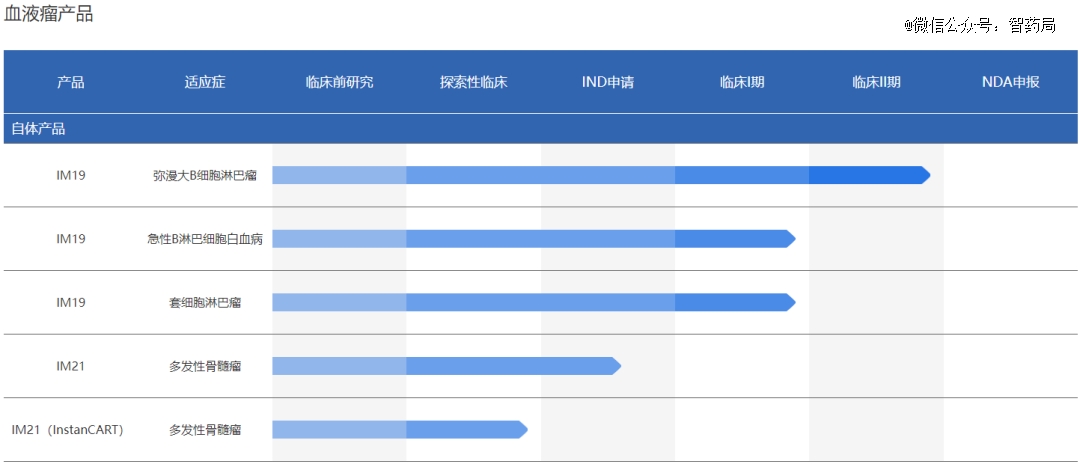
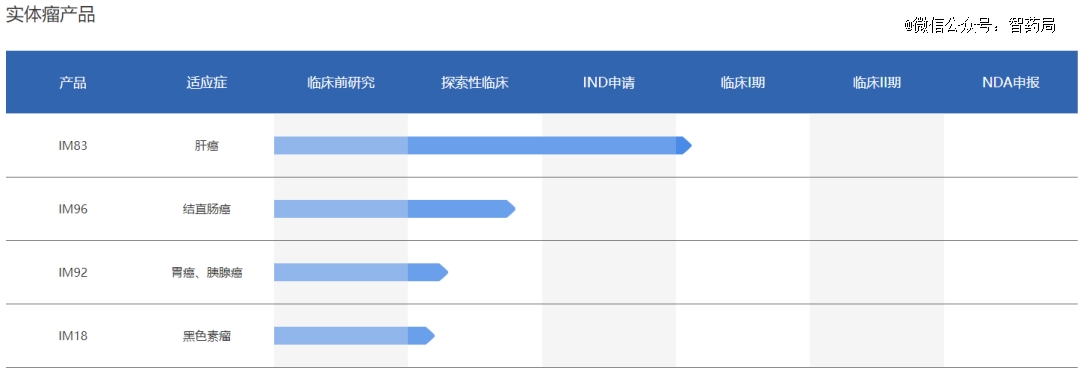
IM19:艺妙神州自主研发的靶向CD19的嵌合抗原受体T细胞治疗药物。其使用了二代CAR分子的设计,并且对CAR分子的序列进行了优化设计,主要作用是增强CAR分子的稳定性,提高CAR-T治疗的疗效,目前已延伸至3个适应症。
IM83:艺妙神州新一代实体肿瘤CAR-T细胞产品,IM83在针对肝癌免疫抑制性强和CAR-T扩增能力弱的问题上,采用了全新的CAR分子设计,显著提高了CAR-T细胞在体内抑瘤的持续性,使其能更有效和持久地与肿瘤细胞战斗。
霍德生物
霍德生物成立于2017年,是一家全球创新、专注于开发iPSC衍生通用型细胞治疗产品的生物技术公司。霍德生物在iPSC重编程、多能干细胞神经分化及多种细胞工程方面具有*的全球专利及创新技术优势,建立了iPSC细胞产品CMC平台,全悬浮自动生产工艺和多种创新分析方法。
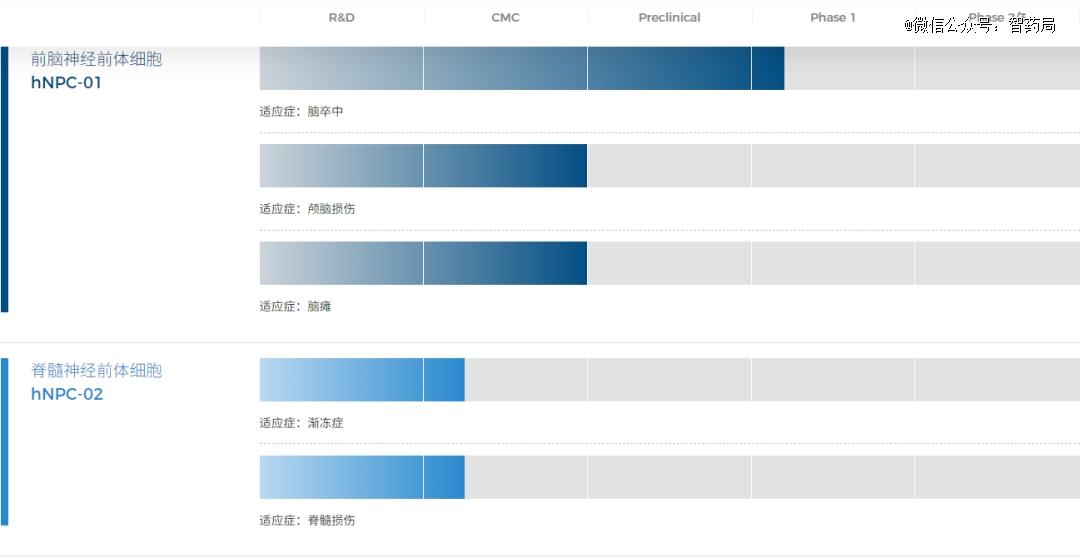
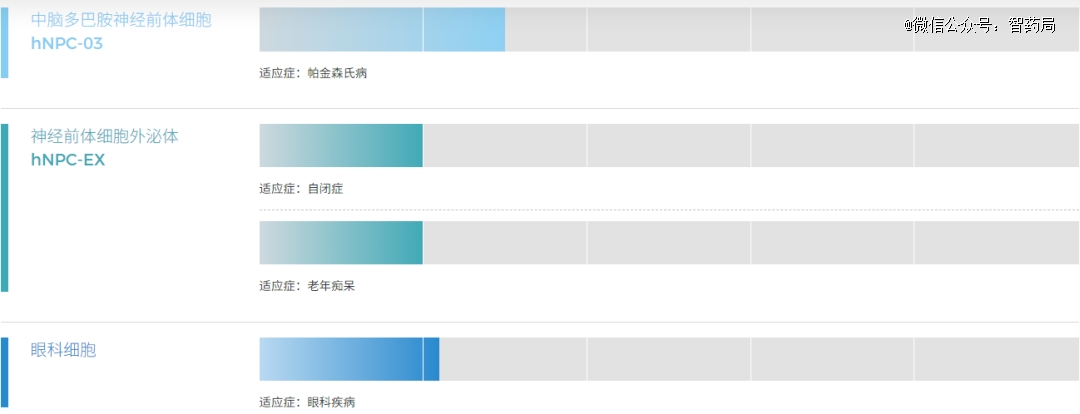
hNPC-01:霍德生物自主研发的全球*IND申报获批的多能干细胞衍生前脑神经前体细胞产品,也是中国*获得cde临床默许的神经类ipsc细胞产品。
目前国际上,hNPC01同类产品仅有斯坦福大学的Gary Steinberg医生主导的iPSC衍生前脑神经前体细胞治疗脑梗塞后遗症的临床研究。该项目由NIH和斯坦福大学等提供资金支持并在2022年4月启动了临床研究。
来恩生物
广州(新加坡)来恩生物医药有限公司(”来恩“)总部位于新加坡,是一家源自新加坡科技研究局(A*STAR),落地中国,面向全球的生物科技公司。公司聚焦于TCR疗法的开发,拥有原创的研发平台,肿瘤靶点,产品管线及相应的知识产权。
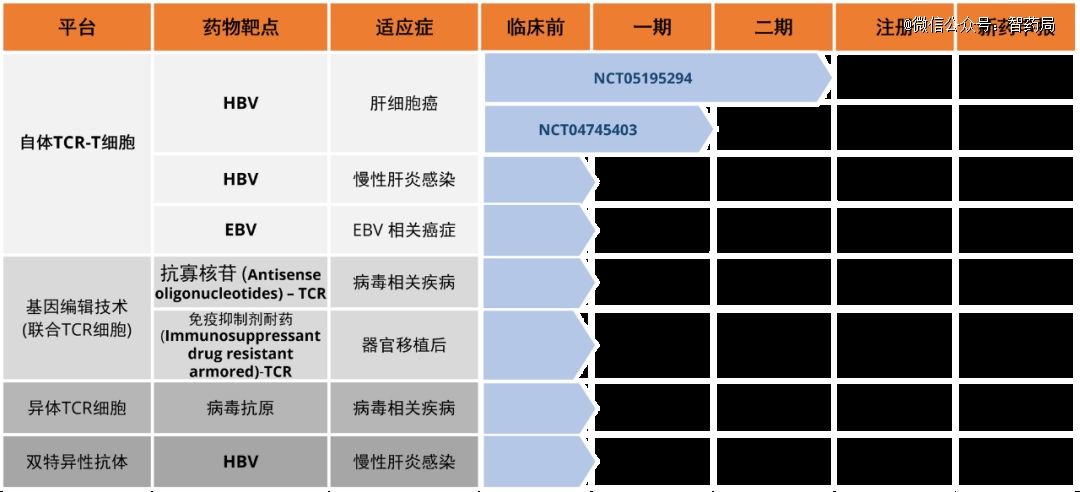
LioCyx-M004:来恩生物开发的一种利用mRNA电转技术靶向乙肝表面抗原的自体T细胞疗法。通过mRNA转染表达靶向HBV抗原的TCR,赋予T细胞特异性识别并杀伤HBV相关HCC肿瘤细胞的能力。
通过有效利用mRNA瞬时表达的特性,结合多次输注的方式,既能很好地控制潜在的毒性又能保证疗效。临床前研究和临床研究数据都显示,这些T细胞能够识别并清除乙肝病毒感染的肝癌细胞。
2、说在最后
细胞治疗作为一种里程碑式的新型治疗手段,突破了传统手术和药物治疗的局限,为癌症等疾病患者提供了全新的治疗思路和途径。
一批本土药企如雨后春笋般而生,大量优秀的临床数据呈爆发式涌现,整个行业呈现出蓬勃发展之势。但要真正实现细胞治疗产业的快速发展,造福人类健康还需要很长的一段路要走。
未来,细胞与基因治疗产业有以下几方面需要重点关注:一是加强临床研究,助力源头创新;二是加强监管措施,消除不确定性;三是注重生产环节,缓解卡脖子技术。