如果说“出海”从前还是中国创新药企的梦想,那么从2022年开始,它已几乎成了一种战略上的标配。
据不完全统计,开年至今,国内共有超过100家药企发生了“出海”事件。
光是上半年,就有超过50家创新药企在积极推进“出海”业务,有的是已在FDA和欧盟递交海外上市申请的“自主出海”,还有的是与跨国制药巨头达成License-out战略合作。
其中,较为活跃的前十家企业分别是:恒瑞医药、百济神州、君实生物、翰森制药、信达生物、科伦药业、荣昌生物、亿帆医药、和黄医药,还有诺诚健华。
而从出海的产品趋势上看,也正在从以大分子创新药向新型技术平台的转向过程中。以今年为例,ADC药物就几乎一骑绝尘,接棒了去年以单抗药物为主的创新药出海趋势。从科伦到石药再到礼新等药企,国内产品的License-out正在让这个赛道持续升温。
不过,License-out的渐入佳境仍不能掩盖自主出海之路的“阻与长”。
从FDA近年的新药审批趋势能够看到,其标准正日渐趋严。今年上半年,FDA批准新药数量仅为16款,远低于2021年和2020年同期的29款和26款。且最近几年,其批准的新药中Me-too和Me-better的比例已在逐年下降,FIC和BIC的占比则在提升。
这也意味着,产品竞争力将成为新药出海首先要跨过的难关。
除此之外,药企的临床开发能力、海外申报注册的能力、商业化能力和全球产业链能力也都决定着全球化之路能走多远。
01、自主出海:部分临床已进入关键期
根据西南证券的不完全统计,目前国内有139个创新药正在海外进行233项临床试验,分属于38家上市公司。
若按照临床试验项目数量来看,百济神州、恒瑞医药、加科思、康方生物、复星医药、亚盛医药等公司可望凭借丰富的出海管线,未来在海外市场收获一席之地和高额回报。
其中,百济神州的替雷利珠单抗和泽布替尼、康方生物的派安普利单抗、绿叶制药的LY03004和 LY03005、君实生物的特瑞普利单抗、腾盛博药的安巴韦单抗/罗米司韦单抗、和黄医药的索凡替尼、亿帆医药的F-62等处于NDA阶段。
除此之外,随着创新药推进至关键临床,药企也将并逐渐步入收获期。
据不完全统计,上述临床试验中目前有33个临床项目处于III期,有望于2023年-2024年上市。其中,恒瑞医药7个项目,百济神州6个项目,君实生物4个项目。
而这些III期项目中,也有很多被市场寄予厚望。
其中包括,恒瑞的“双艾方案”一线治疗晚期肝细胞癌;复宏汉霖的斯鲁利单抗联合化疗一线治疗广泛期小细胞肺癌和局部晚期/转移性食管鳞癌,特别是一线广泛期小细胞肺癌,在美国依然存在巨大的临床需求;贝达药业的恩沙替尼一线治疗ALK阳性NSCLC患者,与克唑替尼相比,恩沙替尼PFS有显著优势,以及百济神州的帕米帕利一线治疗铂敏感复发性胃癌,虽然数据尚未披露,但目前全球尚无PARP抑制剂用于铂敏感复发性胃癌的维持治疗,也有望成为“全球新”。
02、License-out:ADC成主力
除了国际临床试验,License-out更因能有效降低风险,快速回笼资金,而成为出海的主流方式。不过,License-out也有门槛,国外企业在遴选产品时,十分注重技术平台,且通常需要合作产品进入临床II期。
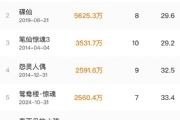
根据西南证券的统计,今年上半年国内药企的License-out数量超过20个。随着国内新药创制水平的不断提升,国产创新药的国际认可度稳步上升,国产创新药License-out金额也持续攀升,目前约有共14个License-out项目的总交易金额超5亿美元。
相比2021年以单抗药物为出海主力,今年的ADC似有比肩之势。截止发稿日,涉及ADC的出海交易超过6笔,远超双抗、CAR-T等领域出海情况。
本就火热的ADC(抗体偶联药物)赛道,今年因DS-8201(Trastuzumab deruxtecan;T-DXd;ENHERTU®)好消息频出又持续升温。
在今年6月举行的美国临床肿瘤学会(ASCO)第58届年会上,阿斯利康和*三共联合研发的ADC DS-8201因其III期临床试验DESTINY-Breast04数据证明获益人群可从HER2阳性拓展至HER2低表达患者而收获全场掌声。紧接着,DS-8201在欧盟被批准用于既往接受过一种或多种基于抗HER2治疗方案的HER2阳性转移性乳腺癌患者。
DS-8201不仅为乳腺癌患者带来新希望,也让ADC赛道焕发新生机。
今年8月,科伦药业发布公告展示了其控股子公司科伦博泰与默沙东进行的两款ADC产品(项目A、B)有偿*许可交易情况。项目A为SKB-264,是一款靶向TROP2的ADC。科伦博泰以超14亿美元的价格将SKB-264中国以外的研究、开发、生产制造和商业化权益许可给默沙东。项目B药物为一款用于治疗实体瘤ADC药物,科伦博泰以9.36亿美元将其全球范围内研究、开发、生产制造与商业化权益售出。
而石药集团子公司巨石生物以11.95亿美元将抗Claudin 18.2 ADC产品SYSA1801在大中华地区以外地区的开发及商业化权益授予Elevation Oncology公司也受到颇多关注。
此外,礼新医药超10亿美元将Claudin18.2 ADC新药LM-302的除大中华区和韩国外的全球权益授予Turning Point公司;普众发现与昂阔医药(OnCusp Therapeutics)就靶向CDH6的ADC产品AMT-707(CUSP06)开发和商业化权益达成许可协议;多禧生物与强生就至多5个靶点开发新型ADC药物达成合作……
可见ADC赛道的红火。
相比ADC赛道交易不断,单抗、双抗和CAR-T细胞疗法赛道稍显温和。
今年年初,君实与Coherus就TIGIT单抗JS006达成合作。Coherus启动行使JS006在美国和加拿大的许可选择权,向君实支付3500万美元首付款,最高达2.55亿美元的开发、申报和销售里程碑付款,以及产品销售净额18%的销售分成。这也是君实与Coherus就PD-1单抗特瑞普利单抗注射液(商品名:拓益)达成合作后的又一授权交易。
今年3月,天演药业与赛诺菲就天演药业独有的安全抗体SAFEbody®技术开展多靶点合作,开发新一代掩蔽抗体候选药物,全部合作交易金额潜值25亿美元以及特许权使用费。这一消息也让业内对抗体技术平台出海有了新的认识。
作为今年业内为数不多的出海双抗药物,和铂医药与阿斯利康超3.5亿美元的合作点燃了今年4月的热门话题。
和铂医药与阿斯利康就CLDN18.2xCD3 双特异性抗体HBM7022的开发与商业化达成全球对外授权协议。HBM7022 是由和铂医药基于公司 HCAb 的免疫细胞衔接器平台 HBICE® 开发的一种新型双特异性抗体,目前正处于临床前阶段。
而信达、驯鹿与Sana Biotechnology公司合作的好消息则掀起了业内对CAR-T细胞疗法及技术平台海外授权的新一波关注。
驯鹿与信达授予Sana其BCMA CAR结构的非商业权利,应用于Sana特定的细胞治疗产品开发。驯鹿和信达可获得首付款以及有资格获得最多6个产品、约为2.04亿美元的潜在开发、注册里程碑付款和销售分成。
今年4月,普瑞金生物宣布与欧洲CellPoint B.V.公司就靶向BCMA的CAR-T细胞疗法PRG-1801达成授权合作。CellPoint B.V.公司将获得普瑞金自主开发的PRG-1801用于血液肿瘤适应证的欧美权益,并负责该产品在欧美地区的临床开发和商业化。普瑞金将获得超过2000万欧元的首付款,以及金额可观的各阶段里程碑付款和超过10%的商业化销售提成。
总体而言,ADC赛道已成今年出海主力军之一,单抗、双抗及CAR-T出海趋势相对平稳。相信随着国内产品更加成熟,会有越来越多的公司主动出海;技术平台有新突破后,也会迎来海外公司新一轮的青睐。
03、出海进入3.0时代
根据BCG的研究,中国创新药的出海已从产品授权驱动的1.0时代出发,走过全球多中心临床的2.0阶段,来到了自建或合作建立国际化营销网络的3.0时代。
在国际化战略上,各大药企都在进行不遗余力的投入和尝试。而率先进入3.0的药企,也将*在出海中获利。
以百济神州为例,其在海外建立的商业化团队显然也在发挥作用。该公司中报显示,2022年上半年,百悦泽(泽布替尼)在全球实现2.331亿美元的销售额,同比大增261.3%。其中在美国的销售更增长5倍,达到1.563亿美元。
尽管已取得不俗的成绩,市场仍认为,泽布替尼距离峰值销售额还很遥远,主要原因是其核心适应证慢性淋巴细胞白血病/小细胞淋巴瘤(cLL/sLL)尚未获批。而该适应证也正是原研药伊布替尼放量的关键。
4月12日,经独立审查委员会确认,泽布替尼在复发或难治性(R/R) cLL/sLL患者中展现出优于伊布替尼的总缓解率。考虑到泽布替尼在与伊布替尼的头对头试验中胜出,市场普遍预计泽布替尼通过FDA审批的概率将变大,而其PDUFA日期预计为2023年1 月,这一时间也因而成为被市场高度关注的时点。
不过,虽然百济神州的泽布替尼和传奇生物的西达基奥仑赛,都是以更优的临床数据叩开了FDA的大门。但今年以来,FDA批准新药的数量明显减少且治疗领域更加多样,这给即将出海的药企提供了一个信号:差异化创新已是势在必行。
曾有专家指出,全球大分子靶点超过100个,中国的研发只集中在最热的前12%,小分子前100的靶点中,中国也只集中研究前40%。这让中国创新药企在六七年时间里就用各种方式把全球卖得*的药都开发殆尽,同质化竞争严重。
可反观今年上半年FDA对新药的批准动作,已似乎在有意地“去同质化”。
其上半年批准的16款新药中,肿瘤药物仅有4款,占比约25%。而去年同期则高达12款,占比44%。其他获批药物的治疗领域则包括失眠、特应性皮炎、血液类疾病等。与此同时,获批企业也绝大部分为中小型生物技术公司,高达10家。
而仔细盘点上半年的创新药出海遇阻的案例,也可以让我们一窥出海之路所要“踩的坑”。
从遇阻的原因来看,信迪利单抗和索凡替尼几乎都是因为均缺少代表美国患者人群的国际多中心临床试验数据;而特瑞普利单抗和艾贝格司亭α注射液则主要因为新冠疫情导致的现场核查受阻。
而这也给我们的出海带来了一个有益的启示,那就是在确保“创新性”和“差异化”的前提下,在研究和申报程序上,也应全面符合美国药品监管的体系要求,这其中也包括美国患者的临床数据和国际多中心临床试验。而对于所有潜在的风险,企业也要做好应对,其中包括疫情导致的风险。