经历了近一年颓势的复星医药久违地迎来了好时光。
自上周起,受到药品专利池组织(MPP)授权国内5家医药公司生产辉瑞新冠仿制药等消息影响,复星医药连续几个交易日大涨,多家证券公司在调研报告中给出利好评价,看好复星医药未来前景。
而在此之前,这家医药公司自去年8月股价达到历史高点以来,此后7个多月的时间中一直处于不断下跌的状态,港股及A股股价均跌去了六成左右,郭广昌的个人身家较去年高点缩水了至少10亿美元。
复星医药在资本市场上遭遇的冷暖与疫苗紧紧相连,人们对疫苗的关注程度远大于这家公司本身的业绩情况。
疫情之前,它一直被人们诟病为投资公司而非一家真正的医药公司,股价常年低迷。疫情之初,它因为引进德国BioNTech的mRNA新冠疫苗而受到追捧,股价随着疫苗生产的推进而不断攀升,4个月内股价翻倍,2021年8月达到历史新高。
但在此后,复星医药的mRNA疫苗复必泰在国内市场却再无更进一步动作,于是股价一路下滑,2个月内暴跌50%。郭广昌也很少在公开场合谈论mRNA疫苗进展,他关于疫苗国内进展的表态是,“看复星医药,千万不要只看疫苗,我们还有好多好产品。”
他呼吁大家多关注关注复星医药的其他业务,疫苗不是他们的全部——但无论是一年前复星医药的暴涨,又或是前两天复星医药的强势反弹,无一例外均和疫苗或新冠*药有关。
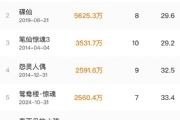
昨日晚间,复星医药公布了2021年业绩报告。复星医药去年营收390.05亿元,同比增长28.7%;归属于上市公司净利润47.35亿元,同比增长29.28%;归属于上市公司扣非净利润32.77亿元,同比增长20.6%。
复星医药将营收增长一部分归功于包括新冠疫苗复必泰在内的新品及次新药品贡献,称包括复必泰在内的新品和次新品收入在制药业务中收入占比超过25%。去年至今,复必泰已经在港澳台地区接种,截至今年2月末三地累计接种超2000万剂。复星医药未透露复必泰的具体销售规模,但表示其销售规模已超10亿元。
与2021年3季度业绩公布的情况类似,复星医药的股价同样在财报发布后下跌。A股及港股股价均在早间开盘后大幅回撤,截至收盘,A股跌去了6.77%,港股跌去了5.92%。
复星医药董事长兼CEO吴以芳在财报后的媒体沟通会上说,“复必泰在内地的申请还在审批当中,目前没有更多的消息可以分享。”
01
国内一众医药公司中,郭广昌是最早认识到疫苗商业前景的企业家之一。
他没有选择像其他一样自行研发mRNA疫苗,而是与德国公司BioNTech合作,研发技术均来自于BioNTech,复星医药仅负责疫苗在国内的本地化生产及销售,这让它得以在早期*大部分国内医药公司。
按照复星医药自己的表述,复星医药在2020年1月与BioNTech首次接触,仅用6周时间双方就达成合作,获得其mRNA新冠疫苗在在中国大陆及港澳台地区内*开发及商业化权益,甚至抢在了国外药企辉瑞之前,辉瑞一直是BioNTech的合作伙伴。
“大家都认为我们比辉瑞快”,吴以芳称,他们早在武汉封城当天就确定了疫苗为集团主要任务之一,当他们开始布局疫苗、挑选合作方案时,还没有其他企业竞争。
当年7月,复星医药引进的BNT162b1疫苗获得国家药监局临床试验注册审评受理;次月,复星医药开始临床I期试验。
11月,辉瑞与BioNTech在国外宣布BNT162b2(BNT162b1的姊妹款,中文名“复必泰”)III期临床测试取得突破进展,有效率达到95%,远超美FDA定下的50%有效率的要求,这是世界上*公布III期临床测试结果的新冠疫苗产品,同时也是当下使用最广泛的mRNA疫苗。
作为BioNTech相关疫苗在大中华区的*授权代理商,复星医药成为最直接的受益者。郭广昌当日晚在自己的个人微信公众号同步了这一喜讯,称期待疫苗能今早在中国上市使用。复星医药两地市值在一天之内暴涨230亿元。
之后,复星医药放弃了BNT162b1疫苗的后续临床试验,转而积极推进BNT162b2。复星医药在当月的电话会议上称,上述疫苗进入中国市场,仅需要开展桥接试验,相当于涵盖Ⅰ期、Ⅱ期临床试验,而不需开展漫长的三期临床试验,上市速度将大大加快。
此后复星医药的相关疫苗推进工作不可谓不快。11月13日复星宣布BNT162b2获国家药监局临床试验批准,仅12天后就宣布将在江苏开展II期临床试验。复星医药一位高管曾对外表示,试验用疫苗在报关后,“连夜”送往试验地点。
国外,美国于12月宣布批准紧急使用BNT162b2疫苗,并在月底成为世界卫生组织*核准使用的新冠疫苗。次年1月,香港批准BNT162b2疫苗在港的紧急使用,预计3月初开始接种。
这让复星医药成为国内一众mRNA疫苗选手中的领跑者,它的一些竞争者甚至还未启动临床试验。当年12月,财新在报道中称,复星医药在上海建立的mRNA疫苗冷库即将启用,该冷库将用于存放从国外进口的BNT162b2疫苗。同时,复星医药拟在国内建设mRNA疫苗产业化基地,一期项目建成后将达产2亿支。
当时复星医药对复必泰在国内的获批上市保持着极乐观的态度,前述高管彼时已经对外透露,称未来新冠疫苗上市后价格不会太高。他称,复必泰的II期试验中的960名受试者在接受了2剂接种并随访半个月后,未出现不良反应,“说明我们这块疫苗是非常安全的,中国和海外的数据是一致的。”
2021年5月,复星医药与BioNTech宣布在国内成立合资公司,进行复必泰疫苗的本地生产及商业化,合作再进一步。当时媒体报道称,复星医药在一次投资者电话会议上透露当前上海的疫苗生产线已经准备就绪,年产能在3.5亿到4.2亿剂,未来可扩大至10亿剂。
02
彼时外界都认为,复星医药的mRNA疫苗有望年中在国内实施接种。《财经》杂志援引复星医药内部人士说法,称他们已经做好一切准备,只要批文下发即可上市。BioNTech的CEO Ugur Sahin也对外称,预计复必泰疫苗最晚将于当年7月前在中国获批。
一些投研机构已经开始估测复必泰上市后将会给复星带来的利润规模。东吴证券给予复星医药买入评级,称参照辉瑞2021年1季度确认的34.62亿美元的疫苗收入,预计mRNA疫苗上市后,“将给复星医药带来巨额业绩弹性”。
6月的股东大会上,复星医药对外透露,除复必泰仍在等待审批外,关于药学的审批流程已基本完成,后续要开展的审批要求和资料也基本都梳理清楚。他们预计,合资协议能在当月落实,8月建成本地化生产线,开始正常生产。与此同时,复星医药也开始大量招聘疫苗相关的销售人员。
7月14日,复星医药再度更新疫苗进展,称国家药监局对复必泰疫苗的审定工作基本完成,已通过专家评审,进入行政审批阶段。“我们和药监局等部门的沟通很顺畅,有关部门对疫苗审批也是一分一秒抓得很紧”,吴以芳说。
此后半个月复星医药两地股价不断上涨,并在8月上旬达到历史最高点,股价较年初已经翻了超过一倍。但人们却没有等来复必泰疫苗的如期上市。
8月23日,复星医药公布2021年中期业绩报告,复必泰疫苗仍处于II期临床阶段,“II期临床试验等工作亦在有序推进中”。当日,美国FDA正式批准复必泰疫苗在美上市,可为美16周岁及以上人士施打。
吴以芳在当时对媒体说,美国FDA的完全批准表示从法律上认可这款mRNA疫苗的技术路线,认可BioNTech的生产技术和生产质量,同时也认可这款疫苗的疗效和安全性。
他针对国内市场的表态已经没有此前乐观,他说,后续他们会按照法定的程序和路径,适时向港澳监管部门提出注册申请,同时也将按内地要求推进mRNA新冠疫苗的注册工作,希望能将该疫苗早日推向市场。
郭广昌则开始呼吁说,疫苗不是复星的全部,它只是复星医药的一个产品。他说,复星当初与BioNTech合作研发疫苗是最不确定、最不靠谱的一个投资,他们的初心是为国家抗疫多一种选择,“我们没有要靠疫苗来提升复星医药的价值,复星未来的发展也不是疫苗就是我们的全部,无论结果如何都会这么做”。
11月,市场上开始流传复星医药疫苗事业部的裁员消息,相关报道称裁员是由于疫苗迟迟未能上市,因此通过裁员节约成本。界面新闻称,裁员计划在11月中旬提出,全疫苗事业部提出了10%的优化指标,但相关计划还存在变数。复星医药对外否认裁员。
直至当下,复星的复必泰疫苗仍然处在II期临床试验中。在国内疫苗接种率已超过87%的情况下,复必泰在国内市场前景有限。复星医药相关负责人向字母榜表示,复必泰国内审批情况以公告内容为准,没有更多消息透露。
目前,复星医药从复必泰疫苗中获得的收入均来自于其在港澳台地区的销售。财报显示,它在2021年上半年从中确认了5亿余元的收入,2021年全年从中获得了超过10亿元的销售收入。
复星医药未透露复必泰带来的利润情况,不过由于复必泰的采购成本、与BioNTech的分成以及7000万美元的授权里程碑费用,拉低了复星医药整体的毛利率,2021年前三季度复星医药的毛利率下降了5.3%。
03
疫苗的故事不再,资本市场又盯上了新冠*药。
3月18日,复星医药对外确认了MPP向其授权辉瑞口服新冠治疗药物奈玛特韦(nirmatrelvir)仿制药生产,以及向覆盖全球约53%人口的95个中低收入国家供应奈玛特韦/利托那韦组合包装签订《分许可协议》。
复星医药是此次MMP授权的5家中国药企之一,其他4家为华海药业、普洛药业、九洲药业及上海迪赛诺药业股份有限公司。除九洲药业仅被授权生产原料药外,包括复星医药在内的其他4家药企可同时生产“原料药+制剂”。
此前,国家药监局已于今年2月附条件批准辉瑞生产的奈玛特韦片/利托那韦片进口注册,这是*个获的国内批准的外国新冠治疗药物,也是国家药监局批准的*治疗新冠肺炎的口服药物。
相关消息见报后,几家公司股价纷纷强势上涨,复星药业及普洛药业均在21日实现涨停,他们被统称为“新冠口服药概念股”。
不过,他们获得销售的许可范围并不包括中国(中国医药负责辉瑞新冠口服药在大陆市场的商业运营)。一些医药行业人士认为由于该仿制药授权主要供给中低收入国家,其售价偏低,利润空间有限。加之该药品生产过程需从全球采购38种不同的原料和试剂,相关原料药企业或许受益更大。
国金证券在其研报中称,获得MPP 授权的企业需要自行解决联合包装中的利托那韦的来源,因此他们看好相关上游原料药及中间体企业。天风证券同样表示,未来随着Paxlovid的全球范围获批与MPP协议的全球销售,相关供应链订单需求量可观且有望保持扩张。
上海市卫生和健康发展研究中心主任金春林在接受媒体采访时称,从长远战略上看,对展示负责任大企业形象和影响力会带来正效应。
复星医药亦在公告中称,鉴于本次许可旨在帮助中低收入国家可负担地获取相关药品,因此定价将低于原研产品或在其他中高收入国家的售价。他们称对公司业绩影响无法预计。
这不是复星医药及国内药企*次获得MPP仿制药授权。今年1月,包括复星医药在内的5家中国药企同样获得了默沙东新冠口服药Molnupiravir的仿制授权。当时获得授权的石家庄龙泽制药相关负责人对媒体说,药品主要销往第三世界国家,预计销售价格不会太高。
除此之外,药企在获得授权后,仍需进行相关试验及在当地注册申报上市工作,也需一定时间才能推向市场。按照MPP的说法,*批药物Paxlovid药物可能将在今年12月前供应,分析公司Airfinity预计到明年5月仿制药才会大规模面向市场。
吴以芳在业绩会上说,复星医药在获得授权仿制后,还需进行新冠口服药的的研发,考虑到制剂的等效、原料成本的竞争力等问题,仍需要一定时间去进行工艺开发和工艺验证。他预计年底复星医药将向WHO提交相关仿制药的申请。
复星医药的股价在消息传出后短暂地涨了几日,之后再度转跌。负责辉瑞新冠口服药在大陆市场商业化运营的中国医药,在14个交易日内经历了230%的非理性上涨之后,终于出现回撤,两日跌去了11.64%。
1. 《国产mRNA新冠疫苗,为何迟迟难问世?》财经杂志
2. 《直击复星医药股东大会:mRNA新冠疫苗审批进展成焦点》每日经济新闻
3. 《从整合者转型进入创新无人区,复星医药蜕变底气从何而来,万字长文详解复星医药创新版图》复星医药
4. 《复星医药国产mRNA疫苗来了!最快月底上市,月产能可达1-2亿剂》财经杂志
5. 《新冠疫苗获批在即,复星医药“赶进度”:工厂已落地,3.5亿剂产能已就绪》经济观察报
6. 《复星医药吴以芳回应新冠疫苗上市:会与监管部门沟通》 *财经
7.《复星医药一年净赚47亿,120万元/针抗癌药售出超百份,预计新冠仿制药年底报批》时代财经