

2020年在新冠疫情中逐渐走向尾声,笼罩在没有*药阴云中、始终未能全然回归疫情前生活的人们,终于看到了黑暗隧道尽头的一线曙光——新冠疫苗。
这场始于今年1月份的全球竞赛,在研发成果上,似乎正在进入终局。英国监管机构已经批准紧急使用辉瑞和拜恩泰科(BioNTech)共同研发的新冠疫苗;美国药监局(FDA)将在12月10日召开公开咨询会, 听取行业专家对疫苗临床试验的数据分析,以完成紧急使用授权前的评估,市场预计12月中旬有望在美国开始接种。同时,另一款美国生物科技公司莫德纳(Moderna)研发的疫苗则有望在12月底之前获批。
资本市场中,乐观情绪找到了宣泄口。拜恩泰科的市值和年初相比已经翻了一番,莫德纳在一个月之内就涨了一倍多,年内疯狂上涨6倍。
“虽然我们对于mRNA疫苗技术还有许多未知,但此刻的问题是,疫苗带来的益处盖过理论中可能带来的风险,何况目前并没有异常的不良反应报告。”费城儿童医院疫苗教育中心主任、FDA疫苗及相关生物制品咨询委员会成员保罗·奥菲特(Paul Offit)对作者表示。
截至12月6日,美国新冠疫情死亡人数超过28万。
疫苗带来的免疫力能持续多久,尚无结论。后续产能、超冷链运输以及公众接受程度,都成为疫苗竞赛中的变量。从紧急使用授权,到大规模批量接种,还需要经历实践检验和数据跟踪,押注全球经济快速重启的投资人,也许高兴得太早了。
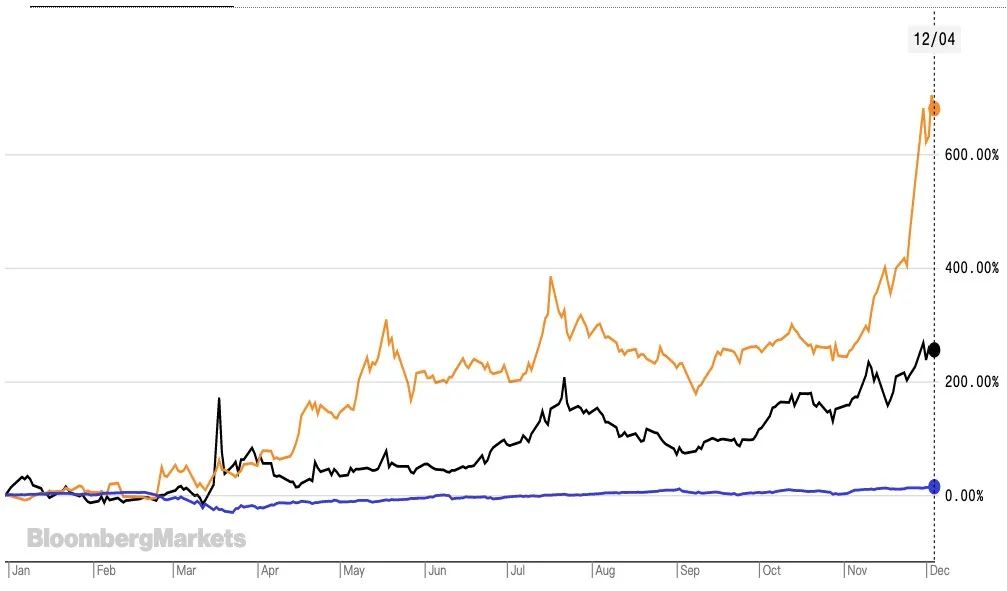
图:截至12月2日,莫德纳股价年内涨幅达到679.75%,拜恩泰科年内涨幅为255.38%,均远超过标普500指数年内14.5%的涨幅。黄线为莫德纳,黑线为拜恩泰科,蓝线为标普500指数
为何是小公司弯道超车?
今年1月,拜恩泰科创始人乌格·萨因(Ugur Sahin)启动疫苗计划时,将项目起名“光速”(Lightspeed Project)。那个时候,占据全球疫苗市场份额九成的大药厂包括辉瑞、强生、默克、葛兰素史克、赛诺菲等还静默无声。
大药厂的按兵不动,源自大流行里疫苗研发的性价比。作为给健康人使用的生物制剂,疫苗的安全性要求更高。一款疫苗从研发到上市的时间一般在8-10年。2003年非典疫苗研发速度*,但药厂依旧遭遇进入大规模临床试验时,疫情已快结束的尴尬境地。
“一款成熟疫苗要成为类似流感疫苗的经常性收入,才可能给大药厂的经济利益产生实质影响。相比之下,小型的生物科技公司灵活应变,也更愿意赌一把。”一位美股分析师对作者表示,“如果能在全球性的竞赛中获得*,可争取到政府等资助,也会让公司一战成名。”
分析师预计,新冠候选疫苗顺利上市后,有望在明年带来30亿美元(约合193亿元人民币)收入。这对年收入518亿美元的辉瑞来说,也许不值一提,但对于目前尚无盈利的拜恩泰科来说,是实现盈利的分水岭。
拜恩泰科和莫德纳能够暂时领跑,得益于mRNA疫苗操作原理的不同。
mRNA疫苗技术的原理,是将编码S蛋白的mRNA注入人体,利用人体细胞在体内合成S蛋白,模拟病毒自然感染人体的过程,刺激人体产生体液免疫和细胞免疫。研发过程的优势在于知道病毒基因序列,即可“人工合成”,在研发过程中不会产生真正的病毒毒株,因此研发时间缩短。
今年1月,中国向世界卫生组织共享了新型冠状病毒基因组序列信息后,*靶点很快被确定为棘突蛋白。3月中旬,美国首位临床试验志愿者就在西雅图接受了莫德纳疫苗的*针注射,历时仅两个月。
拜恩泰科和莫德纳两家从未有过产品上市的“小公司”,因为押注新技术路线,实现了研发上的弯道超车。
但小公司的问题是缺乏临床试验经验,也缺乏国际量产和销售的渠道。拜恩泰科的创始人萨因因此找到了美国*药企辉瑞,两家公司在3月最终签署了一项全球合作协议,共同开发新冠疫苗。
在“2020第二届腾讯中国益公司责任力年度论坛” 对话环节,复星医药董事长吴以芳透露,今年1月底,复星医药就和德国拜恩泰科开始洽谈新冠疫苗的合作事项。2月初达成意向,3月13日签订合作协议。随后辉瑞制药和拜恩泰科签订了中国以外的协议,形成了复星、辉瑞、拜恩泰科三家合作开发新冠疫苗的格局。吴以芳同时透露,这款新冠疫苗有望明年1月在中国获批,最迟一季度面世。
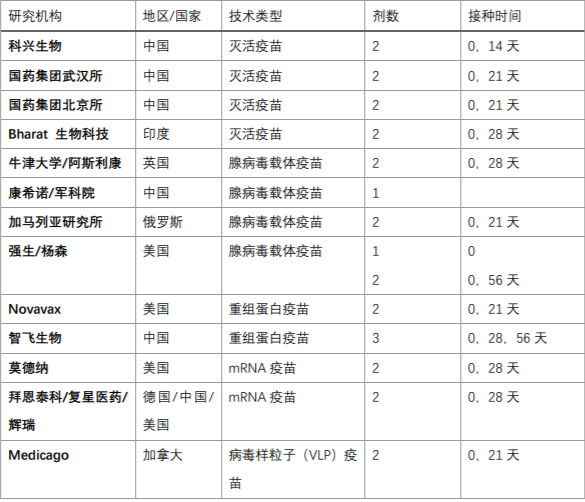
图:目前进入III期临床的13款候选疫苗。根据世界卫生组织官网信息整理
作者根据世界卫生组织官网信息整理发现,截至12月2日,全球共有超过214款候选新冠疫苗正在研发,其中进入III期临床的13款候选疫苗中,中国占据5席。
来自接种者的疑惑
但也因为研发时间史无前例的缩短,暂时领跑的疫苗,率先面临信任问题。
保罗·奥菲特对作者表示,无论是大公司或是小公司,关键在于“数据”。在他的博客里写着,“关键不是我说什么或相信什么,而是数据告诉我们什么。”他也是全球使用的预防轮状病毒感染的儿童疫苗RotaTeq的发明者之一。
在临床试验中期报告中显示,拜恩泰科和莫德纳的两种疫苗的有效性均超过90%。
没有疫苗是100%有效的。一般流感疫苗的有效率约为50%。被称为“美国钟南山”的美国国家过敏症和传染病研究所所长福奇曾经表示,新冠疫苗的有效性需达到50-60%。
有效率的最终数据和安全性数据的积极结果,为制药公司向监管机构申请紧急使用许可奠定基础。
但接种者还是心存疑惑,包括排在队列最前端的医护工作者。
加州大学洛杉矶分校研究人员发布的一份报告显示,洛杉矶的医护人员在回复调查问卷的人中,有66%表示,想推迟接种疫苗。美国护士协会表示,其会员中有三分之一不打算接种该疫苗,还有三分之一的人尚未决定。
疑惑部分来自于对新技术的不确定,部分则来自于对于品牌的不熟悉。一位美国医护人员反复地向作者确认,辉瑞的新冠疫苗真的是由一家尚未有产品面世的生物科技公司开发的吗?那为什么媒体里往往只提辉瑞的名字?
对于新技术的疑惑,奥菲特觉得可以理解:“对于任何新技术,我们都应该心存谦逊的态度。但同时,如果有人觉得打了核酸疫苗就会改变基因的话,就有点过于担心了。mRNA不会进入细胞核。”
对于美国少数族裔担心在III期临床试验中是否充分考虑了不同族群对疫苗的反应情况,奥菲特称,疫苗在不同人体中的反应的确会发生不同,比如65岁以上或者有基础病症的人,对疫苗的反应,可能和毫无基础病症的年轻人不同,但目前还没有数据明确显示,不同种族接受性会发生差异。
提及部分医护工作者的犹豫,奥菲特认为,医护工作者完全有权利选择在更晚的时候接种疫苗,但同时也要考虑到自己可能会暴露在病毒中的风险。
冷链和批量生产的难题
即使人们愿意接种,期待疫苗竞赛已经进入终局、全球经济即将快速重启的投资人,则有些过于乐观。
首先,量产需要时间。就在FDA的咨询委员会会议召开前不久,辉瑞公司宣布调降今年的新冠疫苗产量预期,从9月预计年内供应1亿剂,下调至5000万剂量。辉瑞并未透露产量下调的具体原因。外媒援引知情人士称,由于疫苗原材料部分没有达到要求,导致工期延长,但并未透露具体是哪种原料出现问题。
其次,辉瑞和莫德纳的两款疫苗均对冷链提出严苛要求,特别是,辉瑞的疫苗必须在零下70摄氏度的温度下运输和储存,它在标准冰箱温度下只能储存五天。
世界卫生组织数据显示,疫苗在运输过程中因为缺乏温度控制或连续冷链,通常会出现5-20%的疫苗变质,在部分地区甚至多达50%的疫苗被浪费。这就意味着,如果冷链运输出现瑕疵,将给产能带来更大压力。
随着更多疫苗在明年年初公布三期临床结果,市场份额的座次,可能会发生新的改变。比如,强生公司的腺病毒候选疫苗预计在明年*季度获得中期疗效数据。这种疫苗只需要注射一次就可以产生保护作用,而且只需要普通冷藏方式储存。中国已经进入III期临床试验的5支新冠候选疫苗,也均只需常规冷链储存,意味着能更好地进行跨地域的分发。
考虑到量产产能、有效性比对、运输可及性、产品价格以及医药渠道的不同,2021年的新冠疫苗,将面临多技术多产品共存的局面。而随着一批疫苗的出现,人群的大面积接种或将最终找到遏止新冠疫情继续蔓延的法门。但从科学的角度考虑,这批疫苗所提供的保护力能够持续多久,尚不清楚,在预防无症状感染功效方面也尚无数据。因此,保罗·奥菲特同时提醒道,“有了疫苗不是万事大吉,社交距离等防护措施仍很重要。”