

近月以来,ADC的交易似乎有所冷却。
继HER2、Trop2、B7H3等热门靶点的研发和BD浪潮之后,全球的研发者都在极力的寻找下一个“可成大事”的ADC靶点,PTK7似乎成为了投资者目力可及范围内的下一个热门选项。
6月18日,Day One Biopharmaceuticals宣布与麦科思生物达成*许可协议,以“5500万美元首付+11.52亿美元潜在里程碑+销售分成”条件的代价获得PTK7 ADC产品MTX-13大中华区以外的全球权益。
尽管Day One公司体量并不大,但依旧是在美拥有商业化产品的Biotech。今年以来,普方生物、科伦博泰的PTK7 ADC陆续进入临床阶段,为PTK7 ADC赛道增加了更多的竞争色彩。
01
PTK7靶点的潜力
蛋白酪氨酸激酶7(PTK7),又叫结肠癌激酶4(CCK4),其最早在结肠癌细胞中被发现,其不仅是一种无活性受体酪氨酸激酶(缺乏催化活性的假激酶),也是一种多功能调节因子。PTK7除了在胚胎发生和干细胞功能中具有重要作用,与肿瘤的发生、发展和浸润有关,且与患者预后差有关。
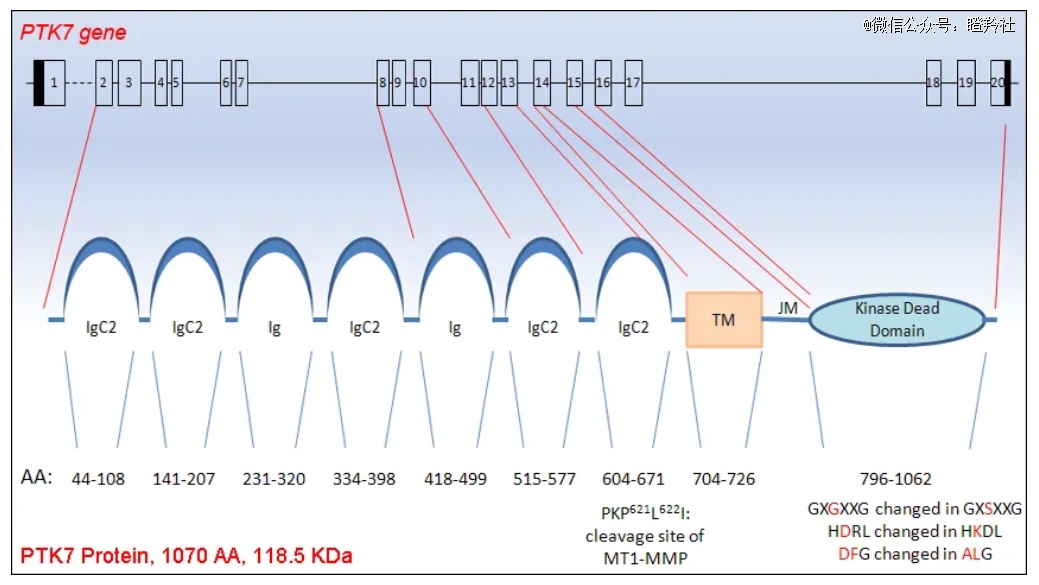
(PTK7的结构)
众所周知,Wnt信号通路是广泛存在于多细胞真核生物中的一条高度保守的信号通路,不仅在胚胎发育过程中起到重要作用,而且与许多人类肿瘤的发生发展也具有密切关系。
虽然PTK7的促肿瘤机制尚未明确,但目前研究者倾向于认为PTK7在VEGF信号通路、非经典和经典Wnt信号通路中的分子开关功能起到了促进肿瘤细胞的定向运动、侵袭与存活和促进内皮细胞的血管生成和肿瘤细胞的增殖等作用。
例如非经典Wnt通路中,PTK7可激活非经典Wnt通路,有利于β-连环蛋白的稳定性和转录活性,从而促进肿瘤的生长。再例如在Semaphorin/Plexin和血管内皮生长因子信号通路中,PTK7/Otk参与该通路的共同受体功能,PlexinAl与血管内皮生长因子-2形成一个可以抑制或刺激细胞迁移起调节作用;PTK7/血管内皮生长因子-1可以促进肿瘤血管内皮细胞迁移和血管形成。
另外,PTK7具备优异抗肿瘤靶点的大部分特质。
PTK7在正常上皮、内皮和造血组织中普遍低水平表达,在大多数正常组织中保持阴性。
并且有研究表明,PTK7在至少三种肿瘤类型(三阴性乳腺癌、非小细胞肺癌和卵巢癌)mRNA水平显著提升,当然其过表达往往与不良预后相关。值得注意的是,PTK7在乳腺癌、卵巢癌和肺癌中的表达率非常高,可达50%以上。
PTK7靶点特性,使得其相关管线具备抗肿瘤新型药物的潜力,尤其是PTK7在乳腺癌和肺癌这样大瘤种上的成药潜力,必定会让不少的制药企业趋之若鹜。
02
MNC先后折戟
在某种程度上可以说,PTK7是一个“起死回生”的靶点。
目前从全球范围看,针对PTK7靶点最早进入临床阶段的分子是一款ADC管线Cofetuzumab Pelidotin,早在2014年底就开启了一期临床。
Cofetuzumab Pelidotin的原研厂商是Stemcentrx,其先后在2016年1月与辉瑞达成合作共同开发Cofetuzumab Pelidotin,随后在2016年4月以102亿美元的对价收购Stemcentrx(20亿美金现金+38亿美金股票+40亿美金里程碑及Stemcentrx手上4亿美金分派给股东)。
可惜的是,随着艾伯维在2023年8月官网管线更新时抹去了Cofetuzumab Pelidotin,以及辉瑞在2个月后宣布终止Cofetuzumab Pelidotin的后续开发,这一First in class的PTK7 ADC先驱管线正式宣告失败。
Cofetuzumab Pelidotin为何会失败?
Cofetuzumab Pelidotin由PTK7靶向的人源化单克隆抗体h6M24、Linker可切割缬氨酸-瓜氨酸和Payload微管抑制剂Aur010组成,DAR值为4。
后视镜角度来看,*代ADC偶联技术往往均一性较差带来很多安全性问题,而采用缬氨酸-瓜氨酸连接子是当下临床最常用的肽连接子,缺点是往往会带来严重中性粒细胞减少剂量限制的毒性;当然,抗体对靶点的亲和力以及Payload的选择也在影响ADC的疗效。
真正让Cofetuzumab Pelidotin停下脚步的,是一期临床数据表现出不高的疗效和较高的毒性。
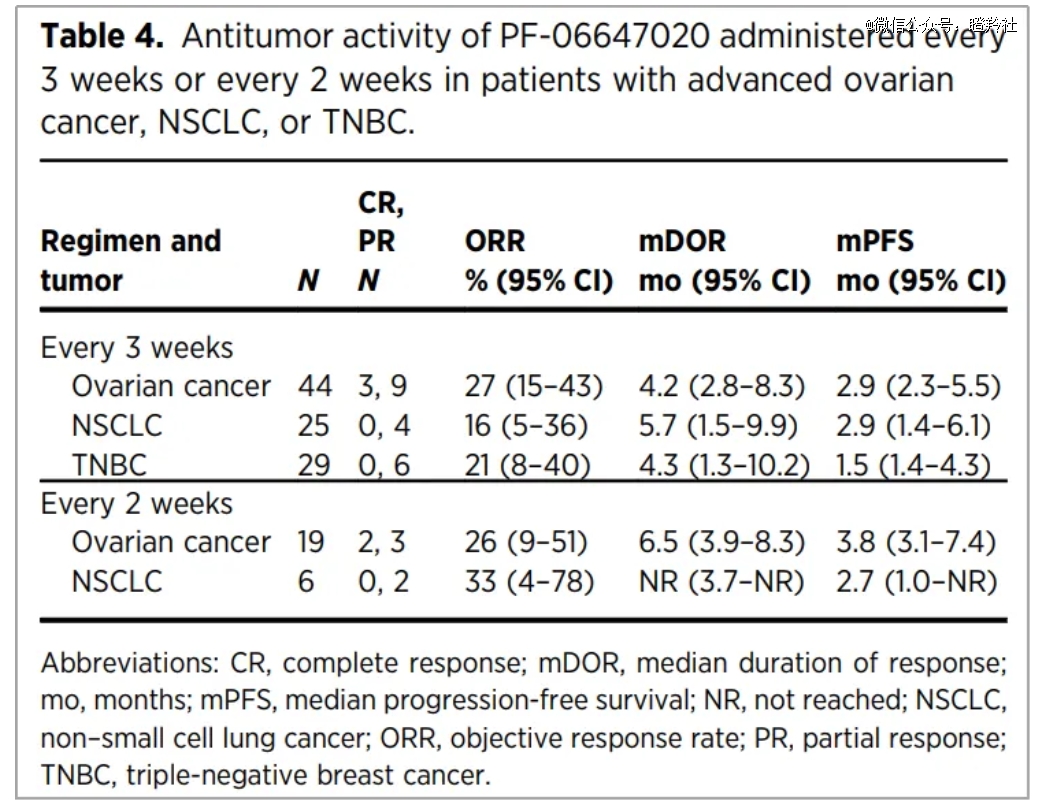
2018年ASCO大会,Cofetuzumab pelidotin首次亮相的一期临床数据显示:在每3周和每2周给药组中表现出抗肿瘤活性,在所有可评估的剂量水平中,卵巢癌患者的ORRs分别为27%和26%,NSCLC为16%和33%,TNBC为21%(每3周方案),尤其对PTK7中高表达的患者人群抗肿瘤活性更好。
安全性方面,无论是每3周和每2周给药,Cofetuzumab pelidotin治疗组患者出现了极高的三级不良反应率,数值高达70%。同时,由于一期临床中有两名患者在每三周给药最高剂量出现3级头痛和疲劳,不得不将二期的推荐最高剂量从3.7mg/kg降至2.8mg/kg。
辉瑞并不是没有想过再“抢救一下”Cofetuzumab pelidotin。
在Cofetuzumab Pelidotin与PI3K/mTOR抑制剂Gedatolisib联用治疗转移性TNBC的一期临床中,16个可评估患者的ORR为16.7%,同时出现较大范围的厌食症和恶心不良反应;
2023年ESMO大会上,Cofetuzumab Pelidotin针对NSCLC临床1b期初步数据显示:56位可评估NSCLC患者总体ORR仅有19.6%。
在两大癌种初步临床探索后的ORR不及预期,以及在新一代ADC分子竞争下,放弃Cofetuzumab Pelidotin无疑是明智的。
03
PTK7 ADC的后浪
国内的PTK7 ADC后浪玩家并不在少数,并且有各自的特点。
以最新授权出海的麦科思生物MTX-13为例,其采用了自主开发的中高亲和力,同时搭配了新型高亲水性Linker连接子T-moiety和拓扑异构酶抑制剂,该分子具有高渗透率和强旁观者效应,药物抗体比(DAR)为8。
可以从一些细节看到,MTX-13在临床前研究中对多种实体瘤都展现出优良的抗肿瘤活性,并且在灵长类动物体内MTX-13最高非严重毒性剂量(HNSTD)≥30 mg/kg,展现出远超Cofetuzumab Pelidotin的潜力。
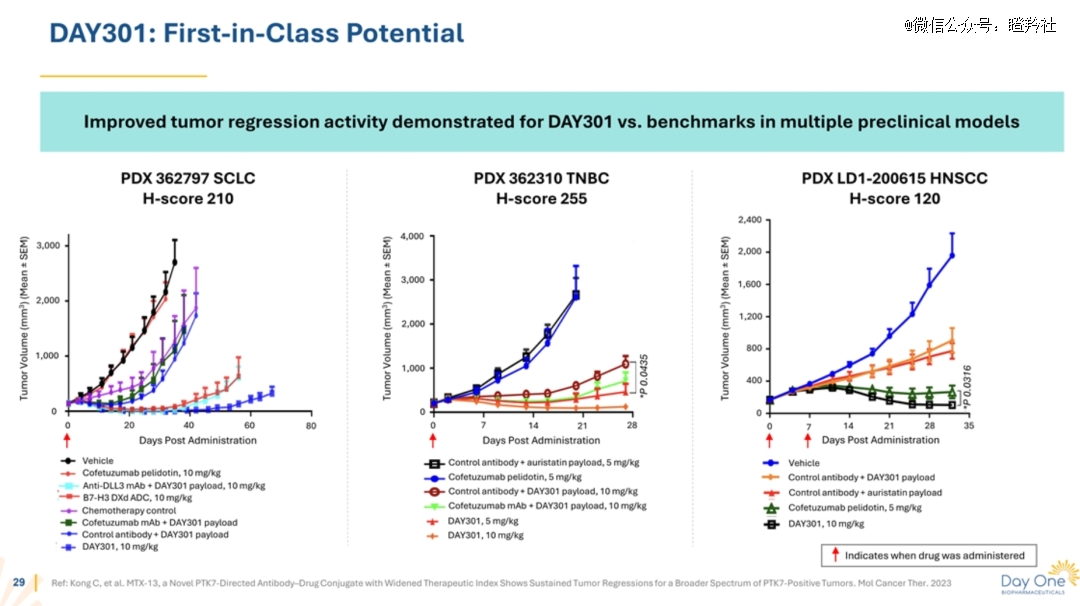
全球PTK7单抗ADC尚未成药验证,国产“PTK7+X”双抗ADC已来。
百奥赛图开发了一款PTK7/TROP2全人双抗ADC药物BCG033,由于PTK7和TROP2均在三阴乳腺癌(TNBC)、卵巢癌、非小细胞肺癌等多个实体瘤中高表达,从机理上可能潜在的抗肿瘤活性更强。
另外再临床前研究中,BCG033在TNBC CDX和BC PDX体内模型中均显示出强大的抗肿瘤活性。
在众多国产PTK7 ADC分子中,进度最快的是被Genmab收购的普方生物PRO1107,今年2月PRO1107就已经在美国推进至临床1/2期研究。PRO1107采用了普方生物自主亲水可裂解Linker,并且载荷搭配了MMAE微管蛋白抑制剂,DAR值为8。
结语:Trop2 ADC的火热还在持续,但部分管线关键临床接连的不及预期,也给了全新的ADC靶点一些机会,尤其是可匹配诸如乳腺癌、肺癌这样的大适应症领域中的未满足需求,PTK7显然是一个潜力靶点。
PTK7 ADC赛道的下一个BD,或许很快就会到来。