

美东时间 7 月 31 日,日本住友制药和大冢制药宣布,其合作在研的 ulotaront 药物的两项 III 期研究精神分裂症临床试验未能达到主要终点。

Ulotaront 是一款利用人工智能技术发现,具有 5-HT1A 激动剂活性的TAAR1激动剂,目前正在研究用于治疗精神分裂症、广泛性焦虑症和重度抑郁症的辅助治疗,并正在考虑其他适应症。
据悉,Ulotaront 是*个也是*一个进入精神分裂症患者III 期临床研究的 TAAR1 激动剂。
受此消息影响,住友制药的股价周一下跌超 10%。
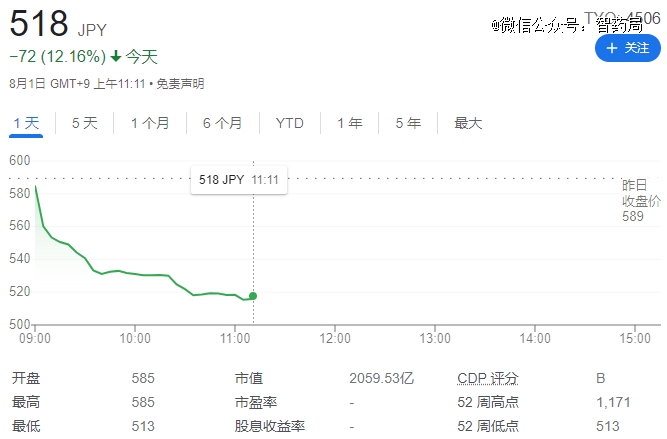
这已经不是住友*次在AI药物上踩雷。就在去年,Exscientia曾经和住友合作DSP-1181已经停止研发,Exscientia还称其为全球*由AI设计进入临床的分子。
AI制药的苦,怎么都让住友尝尽了。
01 2项临床均折戟
DIAMOND 1 研究是一项多中心、随机、双盲、平行组、固定剂量的临床Ⅲ期试验,旨在评估 ulotaront(50 毫克/天和 75 毫克/天)与安慰剂在六周内的疗效、安全性和耐受性,招募了 435 名患有精神分裂症的成年人。
在 DIAMOND 1 研究中,随着时间的推移,所有三组的阳性和阴性症状量表 (PANSS) 总分均有所下降,但在第 6 周 PANSS 总分较基线变化的主要终点上,ulotaront 治疗组均不优于安慰剂。(最小二乘[LS]平均值:ulotaront 50 mg/天和75 mg/天治疗的患者分别为-16.9和-19.6,而安慰剂治疗的患者为-19.3)。
DIAMOND 2 研究是一项多中心、随机、双盲、平行组、固定剂量临床Ⅲ期试验,旨在评估 ulotaront(75 毫克/天和 100 毫克/天)与安慰剂在六周内的疗效、安全性和耐受性,招募了 464 名患有精神分裂症的成年人。
在 DIAMOND 2 研究中,与安慰剂相比,ulotaront 75 mg/天和 100 mg/天治疗组在主要终点方面并未表现出统计学上显着的改善。在第 6 周,与安慰剂相比,两个 ulotaront 治疗组的 PANSS 总分均值较基线有较大的平均下降(LS 平均值:在 ulotaront 75 mg/天和 100 mg/天治疗的患者中分别为 -16.4 和 -18.1,相比之下 - 14.3 安慰剂治疗的患者)。
在 DIAMOND 1 研究和 DIAMOND 2 研究中,观察到较高的安慰剂效应。
但在这两项研究中,Ulotaront 总体上是安全且耐受性良好的。
尽管Ulotaront 两项Ⅲ期结果并不理想,但住友和大冢均表示他们并未放弃该药物,并指出安慰剂的高反应率在精神分裂症试验中很常见,而且这种影响可能因 COVID-19 大流行而加剧。
住友制药代表董事、总裁兼首席执行官野村浩 (Hiroshi Nomura) 表示:“安慰剂的高反应可能掩盖了该药物分子的治疗效果。”
大冢制药总裁 Makoto Inoue 表示,他们表示将与 FDA 讨论下一步行动,同时继续合作探索 ulotaront 的各种可能性,并开发神经精神领域的其他候选药物”。
除了精神分裂症之外,ulotaront 还处于治疗帕金森病精神病的早期临床开发阶段。
02 精神分裂症药物研发
ulotaront 是由住友子公司 Sunovion 和 PsychoGenics 合作开发的一款分子,部分基于使用体内表型 SmartCube® 平台和相关人工智能算法的机制独立方法。
PsychoGenics 是一家人工智能表型药物发现和临床前 CRO 服务公司,主要聚焦寻找治疗严重神经精神疾病的潜在新候选药物。
2021 年 9 月,大冢制药花费了近 9 亿美元(2.7 亿美元的预付款和 6.2 亿美元的 Biobucks)购买住友制药的 ulotaront 和其他三名神经精神病学候选药物的联合开发和商业化权利。
Ulotaront 具有 5-HT1A 激动剂活性的 TAAR1 激动剂,是当时四种药物中*进的一款药物,在 II 期试验中击败了安慰剂。
TAAR1 是一种位于中枢神经系统和外周的 G 蛋白偶联受体,已显示出影响多巴胺、血清素和谷氨酸信号传导的能力,支持其调节与精神分裂症以及其他精神疾病相关的认知和情绪方面的潜力。
今年 5 月,罗氏也取消了其 TAAR1 激动剂 ralmitaront 的II期临床试验,原因是中期分析表明 ralmitaront 不太可能在该研究中达到主要终点。
近年来,精神分裂症药物研发进展可以说是艰难前行,但也有一些疗法正在爆发潜力。
今年 3 月,Karuna Therapeutics 宣布,在研 KarXT(xanomine -trospium)疗法用于治疗成人精神分裂症的 III 期 EMERGENT-3 研究达到了主要终点。
KarXT 由 xanomeline(M1/M4偏好毒蕈碱乙酰胆碱受体激动剂)和 trospium(非CNS渗透性、非选择性毒蕈碱拮抗剂)组成,后者可降低前者的毒副作用,从而将疗效和安全性控制为*。
如果获得批准,KarXT 将成为 50 多年来*个治疗精神分裂症的新药。
Minerva Pharma 的罗鲁哌酮(MIN-101),被证明可以阻断血清素、西格玛和 α-肾上腺素能受体。
此前,罗鲁哌酮在 2020 年的Ⅲ期试验中也失败了,但随后有证据表明,它可能能够针对精神分裂症的阴性症状(例如冷漠和社交退缩),这些症状对当前药物的治疗仍然具有抵抗力。
该药物已向 FDA 备案,已开始审查,将于明年 2 月 26 日做出决定。
03 说在最后
该药物的失败不能也完全把锅扔到AI的身上。
首先得承认,寻找临床前精神疾病全新候选药物困难重重,非常难以评测临床疗效,也导致制药领域对该领域投资缩减,也几乎成为中国创新药企的"雷区“。
PsychoGenics除了将AI用于化合物筛选阶段外,在动物试验阶段,主要利用计算机视觉来分析接受潜在药物治疗的小鼠的行为,用来预测ulotaront临床疗效。
另外,微量胺相关受体1 (TAAR1)靶点并未得到有效验证,因为所有可用的抗精神病药物基本上都是通过拮抗多巴胺D2受体起作用的。
住友与PsychoGenics合作目的也是为了寻找除开针对多巴胺 D2 的药物外,用于精神分裂症的药物,研发风险本身极大。
但也可以看出AI用于药物研发的局限性。一方面,AI制药临床试验接连折戟,且目前还没有一款真正由AI设计研发的新药获批,市场对其仍是怀疑的态度。
另一方面,AI用于加速药物发现已经过验证,最终能否迈过失败率高的临床阶段,度过水逆,还需检验。
一冷一热之间,也有许多公司顶着压力奋勇前行。
Exscientia 第六款由AI平台设计的药物分子 DSP-2342 进入临床Ⅰ期;英矽智能自主研发的全球*由生成式人工智能完成新颖靶点发现和分子设计的候选药物 INS018_055 已推进至II临床试验阶段,都在为市场灌注信心。
临床试验折戟不仅是AI制药的痛点,更是整个医药行业的拦路虎,并不会因为AI的加入就此消失,此次住友的 ulotaront 也是如此。
AI用于药物发现与研发道阻且长,对AI多一点信心,也多一点时间。
参考链接:
https://www.sumitomo-pharma.com/news/20230731-1.html
https://medcitynews.com/2023/07/sumitomo-schizophrenia-ai-drug-discovery-in-two-clinical-trial/




