一直以来,“me better”策略,为药企打造了一个动听的故事。
就像一条捷径,它能够让药企降低原始创新研发的风险,快速通向成功。“药王”礼来,也证明了该路径的可行性。
但凡事,总有两面性。在这条看似*的捷径背后,一路依然充满研发“陷阱”。美国药企Sutro是最新的受害者。
过去,Sutro一度认为,自己研发的FRα ADC药物STRO-002,将会是一款me btter产品,能够将first in class药物掀翻在地。
但遗憾的是,从最新公布的临床数据来看,STRO-002与*问世的FRα ADC药物IMGN853并没有拉开太大的差距,更像是一款me too药物。
作为一款me too药物,在残酷的美国市场,STRO-002的未来难言明朗。二级市场,也用大跌的股价对其临床数据做出回应。
通往“me better”之路,“陷阱”时刻都在。Sutro不是*个掉进“陷阱”的,也不会最后一个。
01 不够*的first in class
FRα(叶酸受体α)是一个充满希望又令许多大药厂头疼的抗癌靶点。
叶酸是人体必须的维生素,不过人体也需要从外界摄取。这就涉及到一个问题,谁来运送叶酸?叶酸受体家族成员们主动承担了这一职责。
其中FRα是最有望成为药物靶点的受体,除了运送叶酸,FRα还能调节癌细胞关键发育基因的表达,研究发现,在癌细胞增殖、转移的过程中,FRα也起着推波助澜的作用。理论上,通过抑制FRα可以控制肿瘤的转移、侵袭。
不过,在实际过程中,想要驾驭这一靶点难度不小。90年代发现至今,只有一款药物上市。此前默沙东、卫材等*药企,针对FRα靶点开发的偶联药物、单抗均以失败告终。
直到2022年,在这一领域深耕多年的immunogen才改变了情况。在一项名为 SORAYA 的单臂临床试验中,IMGN853 单药治疗具有高FRα表达的铂耐药卵巢癌达到临床终点,客观缓解率为32%,中位缓解持续时间为6.9个月。
鉴于这一临床数据,2022年11月15日,IMGN853获得了FDA加速批准上市,成为*获批上市的FRα ADC。
尽管头顶first in class光环,但IMGN853难称*,甚至还有不少bug有待攻克。
创新药最重要的评价标准,自然是疗效。在这方面,IMGN853的问题在于,其只对高度表达FRα的患者有效。而这类患者只占据卵巢癌人群的35-40%,对于更多的FRα中低表达患者,IMGN853束手无策。
疗效之外,安全性也是评价一款药物的关键指标。毒性问题是FRα药物的隐忧,IMGN853也不例外。
在临床试验中,31%的患者在使用IMGN853时出现了严重的不良反应。眼毒性更是不能忽视的问题,一名患者因视力障碍而终止治疗。为了提醒人们注意这一副作用,FDA直接给IMGN853打上了黑框警告。
对于FRα ADC领域的后来者而言,IMGN853的这些缺陷便是突围机会所在。对FRα ADC虎视眈眈的药企们,试图通过对FRα ADC进行结构改造,以弥补IMGN853的漏洞,打造更好的me better药物。
海外方面,SUTRO、卫材等药企都在寻找机会突围;国内也有不少玩家蠢蠢欲动,百奥泰、普方生物的FRα ADC都已进入一期临床。
02 奋起直追却难成me better
与HER2 ADC赛道人满为患不同,全球进入临床的FRα ADC也仅有3款。但这并不意味着FRα ADC竞争不激烈。
FRα ADC最残酷的战场,在美国市场。Sutro则是这个战场上,最渴望的击败immunogen的玩家。原因无他,immunogen与Sutro注定只能活下来一个。
这并非危言耸听。Sutro原本打的算盘是,通过早期临床数据使STRO-002获得加速审批上市。
所谓药物加速审批,可以理解为一种先上车后买票的药物评审方式。对于针对那些无药可治疾病的新药,FDA会给它们提供一条“捷径”,即凭借早期临床数据先上市,后续再把数据补上以获得完全获批。此前,IMGN853针对晚期卵巢癌便是通过这一“捷径”上市。
但是IMGN853却打乱了STRO-002的如意算盘。IMGN853预计将于2023年初获得临床研究的关键数据,若是一切顺利,IMGN853将会获得FDA的完全批准。
这可能会让STRO-002无路可走。因为在IMMGN853和STRO-002瞄准相同适应症的情况下,如果IMGN853获得了完全批准,那么STRO-002将很难再获得加速批准的机会。
除非STRO-002能成为一款me better药物,也就是临床数据比IMGN853优秀很多。但目前看来,这种可能性不大。
此前,STRO-002宣称自己的优势在于能够无论FRα表达水平如何都能有效,但实际却并非如此。
1月9日,STRO-002公布的最新临床数据显示,41名卵巢癌患者中,在FRα中高表达( TPS > 25%)的患者中,客观缓解率达到38%,略高于IMGN853的32%。但在中位持续缓解时间上,STRO-002为5.5个月,略低于IMGN853的6.9个月。即便只看高表达(TPS>75%)患者,STRO-002的客观缓解率也只有40%,优势并不明显。
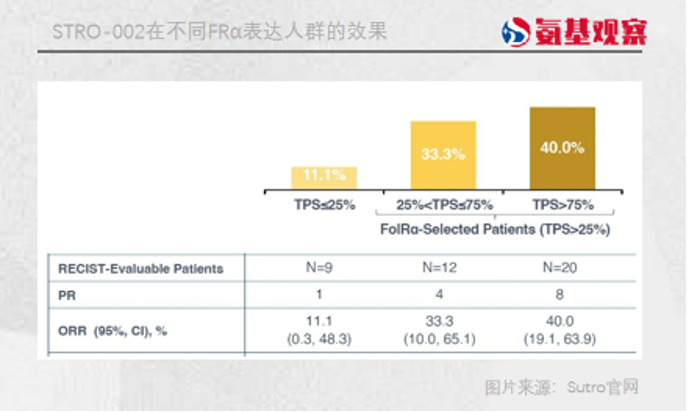
在安全性方面,STRO-002虽没有出现眼毒性,但也有着属于自己的困扰。STRO-002与 70%的严重中性粒细胞减少症相关。
在5.2mg/kg剂量组中,更是有一位患者因中性粒细胞缺乏伴发热而死亡。要知道中性粒细胞减少一直是恶性肿瘤治疗过程中较为棘手的并发症,这一副作用势必也会限制STRO-002的想象空间。从安全性上,也很难说STRO-002优于IMGN853。
综合来看,STRO-002更像是一个IMGN853的me too药物,而非me better药物。
这也就意味着,一旦IMGN853完全获批上市,STRO-002大概率只能通过完整的三期临床数据申报上市。而这将要求SUTRO花费更多的时间和金钱,同时在进度上也将被IMGN853落下更大的距离,即使最终成功上市,STRO-002的商业价值也要打上一个问号。
作为SUTRO的拳头产品,STRO-002的表现也让投资者大失所望。STRO-002数据公布次日,SUTRO的股价跌去了12.42%。
03 警惕me better“陷阱”
Sutro打造的me better故事,几乎幻灭。但Sutro不是*个掉进me better“陷阱”的,也不会是最后一个。
一直以来,me better都是众多药企的核心策略之一。
这不难理解,me better药物只需要在前人已经验证过的道路上,针对现有问题进行改造,就能得出一款更好的药物。这让me better药物研发变得简单许多。
并且,在me better药物的历史上,有着太多成功的的案例。比如,礼来的GLP-1度拉糖肽,靠着用药时间上的优势后发制人,在2020年以53亿美元销售额成为GLP-1领域的销售冠军。
在这些案例面前,人人都觉得自己能够研发出下一个成功的me better药物。但凡事总有两面性,me better药物研发过程,依然充满了看不见、想不到的危险。
简单来说,目前上市的分子靶向药物作用机制非常复杂,往往牵一发而动全身。如果对靶点的理解不够深刻,优化化合物的经验不够丰富,那么很可能在实际操作中,一个看似无关紧要的改变,就可能会使得药物的活性、半衰期、亲和力发生改变,进而“翻车”,me better变me too甚至me worse。
可以说,在一定程度上,药物的研发就像开盲盒,理论和实际之间差了十万八千里。不到临床数据出炉那一刻,一款药物究竟是不是me better,谁也不好说。
这种例子,也并非不存在。此前康乃德宣布IL-4Rα抗体CBP-201,治疗中重度特应性皮炎的全球二期临床达到主要终点。不过,该临床试验成功,康乃德股价不升反降,走上了持续暴跌之路。原因就在于,其核心产品CBP-201的预期,由me better变成了me worse。
这样的故事绝非个例。这也告诉我们,在追求me better药物的同时,药企也应该意识到,这*不会是一次轻松的征程。
脱颖而出的,终究只有少数实力选手。