

前言
生命奥秘的答案,就隐藏在遗传物质DNA的四种碱基的排列组合中。随着分子生物学的飞速发展,对于基因的读、写、改都有了成熟的工具,人类对理解生命体,改造生命体的能力正处在一个飞速发展的阶段。基因的编码对于生物体的性状起决定性作用,大量疾病的表型是由于DNA序列的改变,包括碱基的突变,缺失和替换。如何实现基因的精准编辑,通过操纵基因来实现生命体的精准调控,涌现出众多的初创公司与投资机会。本文阐述了基因编辑的发展历史,市场情况,CRISPR技术的起源,发展和未来;梳理了技术难点与竞争格局,就基因编辑的发展趋势及投资机遇进行了探讨。
富华资本认为,基因编辑在农业,合成生物,疾病治疗等领域都拥有无法预估的潜力。在人们最关心的疾病治疗领域,基因编辑的有效性和安全性仍有瓶颈。于是,基因编辑工具的设计、筛选及优化,编辑效率的提升,递送系统的设计和制造,基因编辑脱靶率的控制,每个环节上都孕育着新机会。
基因编辑技术的发展历史,CRISPR及其“衍生”技术占领市场
基因编辑技术,是近三十年以来最伟大的技术发明之一,2020年诺贝尔化学奖授予了两位基因编辑技术CRISPR/Cas9的发明者。图1归纳了基因编辑发展过程中,不可错过的大事件。1985年,哺乳动物细胞内的靶向基因整合频率为10-6,基本认为是一个不可控的随机事件。1994年,科学家发现了DNA双链断裂可引导修复机制,即DNA在发生断裂之后,拥有一套自我修复的手段,这个机制为整个基因编辑技术提供发展基础。1996年,*代基因编辑技术,经基因工程改造的锌指核酸酶(Zinc Finger Nucleases; ZFNs)被设计出来,开启人工改造生命体的旅程。2009年,开发了第二代基因编辑技术,类转录激活因子效应物核酸酶(Transcription-like activator effector nucleases; TALENs)。ZFNs和TALENs技术都需要设计,合成并且组装带有特异性DNA识别功能的复杂蛋白模块,构建周期长,步骤繁琐,难以进行高通量基因编辑,极大限制了其推广应用。直到2012年,CRISPR技术横空出世,仅需要遵循DNA-RNA碱基互补配对原则,利用RNA介导的核酸酶与DNA的靶序列结合就可达到基因编辑的目的。它的出现弥补了各种编辑技术的缺点,其系统简单、精准、编辑效率高,极大降低了技术门槛,使得基因编辑大范围进入植物、动物、微生物等各个研究领域,引发新一轮基因编辑研究热潮。在2014年,CRISPR Therapeutics, Intellia Therapeutics, and Editas Medicine,目前享誉全球的三大基因编辑治疗公司,分别由三位CRISPR领域的领军人物(Emmanuelle Charpentier, Jennifer A. Doudna, Feng Zhang)所创立,开启CRIPSR基因治疗的新篇章。然而,CRISPR技术的革新还一直在进行,鉴于双链断裂所产生的DNA修复不可控的风险,David Liu在2016年发明了碱基编辑器,在2019年发明了先导编辑,弥补了CRISPR本身的缺陷,基因编辑正式进入精准时代。目前,大量基因编辑的临床管线还处在早期阶段(临床I期),进展速度最快的要属CRISPR Therapeutics的基因编辑治疗药物CTX001,一种体外的基因编辑疗法,治疗镰状细胞病和输血依赖型β地中海贫血,目前已经启动CRISPR细胞治疗产品的FDA滚动上市申请,如果顺利获批将成为*FDA批准的CRISPR药物。
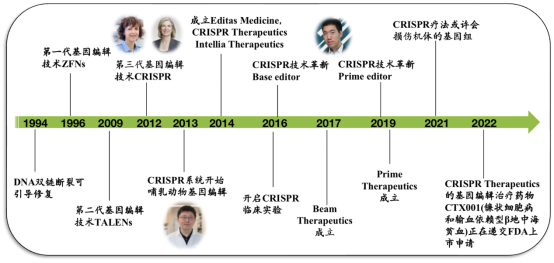
图1 基因编辑发展历史
基因编辑的市场和临床情况,以肿瘤和罕见病为主要临床应用
根据Global Market Insights,2021年全球基因编辑市场超过54亿美金,2030年将超过199亿美金,期间内复合年增长率为15.5%。根据BIS Research Inc., 2020年全球CRISPR基因编辑市场价值10.9亿美元,预计到2031将达到188.6亿美元每年,预测期内的复合年增长率为29.60%。CRISPR作为重磅的基因编辑工具,一经发现就迅速取代其他的基因编辑方式,占领了基因编辑的半壁江山,市场份额远超过ZFNs和TALENs。按照地域来看,北美作为基因编辑技术的*的地域,拥有大量专利和临床管线,在全球的市场占有率超过一半。基因编辑的应用很广,有细胞编辑,食品行业,动物医疗,生物检测等等,然而目前最主要的应用(占比超过40%)还是集中在以细胞编辑为基础的治疗手段上。
从富华资本的视角,进一步分析CRISPR基因编辑在临床上的应用,详情见图2。基因编辑主要治疗的疾病在肿瘤(细胞治疗),以及罕见病上。2021年,全球细胞治疗市场为72亿美金,治疗手段多种,包括CAR-T;TCR-T;NK;TIL,适应症以血液瘤为主,开始逐步跨越到实体瘤,一旦在实体瘤领域有所突破,将会成为未来肿瘤治疗的一个主流方式。开发出通用型CAR-T是细胞免疫疗法的*目标,异体T细胞移植存在免疫排斥的风险,而利用CRISPR技术敲除内源性T细胞受体和表面的人类白细胞抗原HLA,同时优化CAR的表达增强抗肿瘤效果,使通用型CAR-T成为可能。CaribouBiosciences在今年5月宣布,其通用型CAR-T疗法CB-010在治疗复发/难治性B细胞非霍奇金淋巴瘤患者的1期临床试验中获得积极结果。该疗法利用CRISPR敲除PD-1以增强抗肿瘤活性,总缓解率ORR达100%,完全缓解率CR达80%。为通用型CAR-T的研发带来新的曙光。
对于罕见病而言,全球确认的罕见病大约有7000多种,80%是由基因缺陷导致,而仅有几百种的罕见病有治疗药物,大部分的罕见病缺乏治疗手段,给患者带去了极大的痛苦。据统计,全球罕见病药物市场规模在2020年有1351亿美金,基因编辑提供*疗法,拥有巨大的市场空间。在罕见病中,目前基因编辑运用较多的基因治疗管线集中在血液病和眼科疾病。血液病由于患者人数较多,且疾病机理较为明确,包括地中海贫血,镰状细胞病,是目前CRISPR基因治疗最拥挤的赛道,也是目前有可能最快上市的的治疗手段。CTX001作为地中海贫血和镰状细胞贫血患者的明星疗法,编辑位点为BCL11A的基因,抑制该基因的表达可以让患者体内的胎儿血红蛋白水平重新上升从而缓解贫血疾病,目前接受治疗的患者症状都消失,不再依靠输血维持。此外,罕见病中,眼科疾病比较特殊。由于眼球的独特生理构造,作为一个封闭体系,非常适合做基因药物的递送,安全性比较高。目前,基因编辑疗法集中在遗传性视网膜病变的治疗,包括视网膜色素变性,雷伯氏先天性黑曚,先天性静止性夜盲等疾病。雷伯氏先天性黑曚的病人中,CEP290的基因突变较为常见,EditasMedicine将CRISPR编辑系统通过AAV5递送至感光细胞,将突变的内含子区域删除从而恢复CEP290基因的正常表达。随着CRISPR技术的发展,基因编辑对眼科疾病的治疗也进入爆发阶段。

图2 CRISPR基因编辑治疗在临床上的应用
来自细菌的的免疫系统:CRISPR的起源和作用机制
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats;成簇的, 规律间隔的,短回文重复序列)是由细菌进化出来,抵御病毒的一种工具。CRISPR序列中的重复序列高度保守,而当病毒入侵细菌时,细菌中的“防御警察”,Cas蛋白,会把病毒DNA的一部分剪下来,放入重复序列的间隔区,于是就形成成簇的,规律间隔的,短回文重复序列,也就是CRISPR的缩写的由来(具体过程见图3)。细菌收集病毒DNA的目的,类似于获取病毒“身份证”,然后对其身份进行存档。当Cas蛋白拿着身份证四处巡逻,一旦看到相同的序列,也就是病毒,Cas蛋白就会剪断这个病毒,保护细菌免被病毒感染,所以这是一套高效的细菌防疫机制。模拟这套防御机制就是进行基因编辑的基础。首先,利用基因编辑位点处DNA的碱基互补配对原则来设计一个guideRNA,guideRNA与Cas蛋白结合之后,就会找到需要基因编辑的相应DNA片段位点,并且剪断该位点的DNA。与此同时,递送一个正确的基因作为模版,那么,细胞就有机会把正确的模版拿来修补DNA的缺口,完成基因编辑。[YW2]
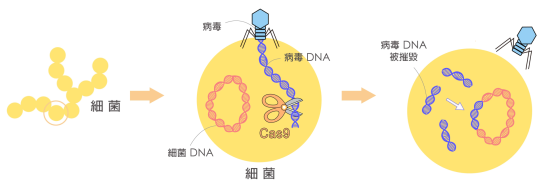
图3 CRISPR的来历;
图片来自https://research.sinica.edu.tw/gene-editing-crispr-lin-chia-hung/
行业发展瓶颈:CRISPR的脱靶效应与安全性问题
CRISPR技术的安全性问题一直是关注的焦点。这里就不得不讨论基因编辑*的局限性,即脱靶效应。脱靶效应会导致假表型,造成基因编辑系统在错误的位置进行修改,对病人产生巨大的风险。造成基因编辑的错误修改原因有三种,*,CRISPR-Cas9系统无法精确到只和靶序列结合,gRNA和靶序列的碱基配对并不是*且*的,CRISPR-Cas9系统有可能会结合到与目标片段相似的片段,然后在多位点都进行基因编辑。第二,当CRISPR-Cas9系统与靶序列结合之后,他的切割操作并不精准,切割的具体位点随着DNA序列的改变可能出现偏差。其三,基因编辑依靠外源DNA做同源修复,这种修复方式效率很低,实验结果表明,最终可能造成碱基的突变,DNA片段的缺失和插入。
近些年来,关于CRISPR安全性研究的论文层出不穷。2018年7月,利用三代基因测序技术,英国Sanger研究所的团队在NatureBiotechnology上发表论文,发现gRNA作用靶点附近会产生DNA片段的大幅度缺失,验证了基因测序技术的不恰当所造成人类对基因编辑结果的不合理评估。2019年3月,法国波尔多大学的研究人员在Nature Communications发表研究成果,表明CRISPR基因编辑会诱导出现百万碱基规模的染色体大片的的缺失,揭露了Cas诱导的DNA双链断裂可能对人体细胞造成不可控制的破坏性作用。2021年4月,哈佛医学院David Pellman团队在Nature Genetics上发表论文,研究发现CRISPR会破坏细胞和结构导致染色体破裂,表明我们对基因编辑的技术安全和相关机制了解还有所欠缺,CRISPR基因编辑技术的安全性评估上仍需谨慎。2022年3月15日,FDA发布了一项涉及人类基因组编辑的人类基因治疗产品的指导文件草案,表明基因编辑对于靶标位点和非靶标位点的长期影响未知,FDA建议在在基因编辑治疗后对患者进行至少长达15年的长期跟踪随访。以对各种安全性评估问题包括脱靶,染色体变异等潜在风险进行观察,监测和表征。
上述研究的安全性问题,大多是由于DNA双链断裂可引导修复机制所导致。引起DNA双链断裂的原因有很多,比如放射性物质的辐射,化学药品,细胞自身代谢产物等外源或者内源因素,都会直接诱发DNA双链断裂(Double Strand Break, DSB),这对细胞是致命的。所以,针对这种情况,细胞进化出自我修复机制,一个是通过非同源性末端粘合(Non-homologous end joining; NHEJ)进行的DNA修补,另一个是通过同源重组修复(Homologous recombination repair; HDR)进行的DNA修补(图4)。用比较通俗的语言形容这两种修补方式,NHEJ简单粗暴且高效,一旦发现DNA断裂,就迅速对断裂处进行修补,可能产生碱基的随机插入或者缺失,常常导致基因失活。如果外源基因供体存在时,则会通过NHEJ实现定点的基因敲入。这个过程中修补结果不可控,所谓不够精确,也叫易错修复。相比之下,HDR是一种较*的修复方式,HDR需要以染色单体的同源序列作为其修复的模板,按照模版来进行修复。有研究发现,CRISPR联合NHEJ介导的DNA 随机整合频率比CRISPR联合HDR引起的DNA插入片段高出1000倍以上,虽然NHEJ在体内外的介导的基因敲入的效率高于HDR,但由于错配率高,修复过程中易发生插入和缺失,单碱基的突变无法实现,精准的基因编辑仍然面临巨大挑战,这也是CRISPR后期衍生出新技术的理论基础。
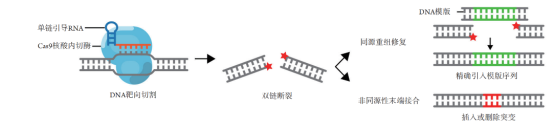
图4 CRISPR/Cas9基因编辑技术原理
(图片引用自文章“CRISPR基因编辑技术及其在眼科疾病中的应用进展” )
CRISPR 2.0版,碱基编辑和先导编辑带领基因编辑进入精准时代
CRISPR技术未来的发展趋势,一个方向为开发出不依赖DNA双链断裂的精准基因编辑手段,进而推广其在基因治疗中的应用。单碱基的变异导致了人类2/3的遗传病的发生。由于DSB引发的DNA修复很难实现高效稳定的单碱基突变,2016年,碱基编辑器(Base Editor, BE)被研发出来,补上了这一块的空缺。BE的原理简单来说,就是把没有酶切活性的dCas9和胞嘧啶去氨基酶设计成融合蛋白,然后在gRNA的引导下和靶标序列结合。当dCas9结合到DNA上之后,因为没有酶切活性,不会引发双链断裂,但是连着的脱氨酶会直接在该位点催化去氨反应,比如将胞嘧啶C转换为尿嘧啶U,U-G错配之后被内源DNA修复机制改为胸腺嘧啶T (BE机理见图5)。BE不需要引入DSB以及修复模版,效率远高过由DSB引起的同源重组修复,是单基因突变型罕见病的有效治疗选择。目前已经有多种碱基编辑器问世,CBE(C到T的编辑),GBE(C到G的编辑),ABE(A到G的编辑)等。但是,碱基编辑技术也存在瓶颈,比如仍旧有脱靶的问题;不能实现任意两个碱基的转化;只能改单碱基,不能做插入和删除;编辑精确度差:编辑范围在几个碱基内,比如,在编辑范围内所有的C或者A都会被转换成T或者G。碱基编辑器出现之后,大量的研究开始不断筛选和设计,致力于推出精度更高的碱基修饰酶。
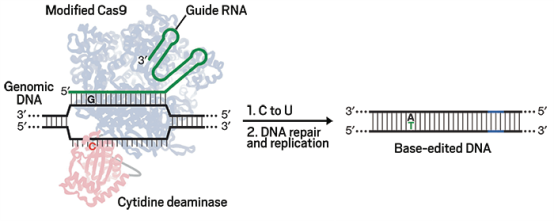
图5 碱基编辑器原理
图片来自https://cen.acs.org/articles/94/i17/Improved-route-single-base-genome.html
另外一个拥有巨大潜力的基因编辑技术是2019年研发的先导编辑(Prime Editor, PE),跟碱基编辑器只能编辑单碱基相比,先导编辑的优势在于基因编辑的类型多样,包括碱基的任意转换,精准敲入和敲除。同时,不同于CRISPR-Cas9通过递送的基因模版来进行DNA修复,先导编辑中的gRNA被改造成了pegRNA(Prime editing guide RNA),即除了向导RNA之外,还有修复模版。将Cas9蛋白连接上逆转录酶,于是pegRNA可以和逆转录酶结合,逆转录成DNA序列,然后将DNA序列直接插入到靶基因中去,大大提高了基因编辑过程中将靶DNA片段替换成目标序列的可能性。表1对比了不同基因编辑的技术的优点和局限性,理论上,先导编辑的出现,带领基因编辑进入精准时代。2021年10月,刘如谦教授创立的下一代基因编辑公司PrimeMedicine上市,共有18个临床管线,针对血液,肺,眼睛,耳朵等多个器官和组织,包括镰状细胞病,威尔逊氏病,色素性视网膜炎等管线,目前还没有管线进入临床阶段。PE出现的时间还很短,各种参数还需进一步进行试验验证。目前的主要瓶颈在于,编辑的效率比较低,体系复杂,编辑系统大从而对于递送系统有挑战。
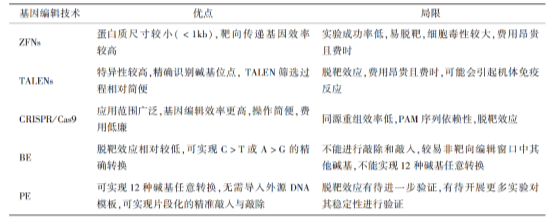
表1 不同基因编辑技术的比较,
表格来自论文“基因编辑技术及其在疾病治疗中的研究进展和应用前景”
富华资本观点:行业竞争格局与潜在投资机会
在基因编辑领域基础研究飞速发展的今天,大量公司也如雨后春笋般涌现。据公开信息的统计,2021年基因编辑领域中有超过56家公司获得融资。虽然临床上给予了基因编辑很高的期待,但是基因编辑仍旧面临巨大的挑战。首先,基因编辑在不同病症中的疗效有待考证,2021年Editas Medicine发布了其治疗先天性黑蒙眼疾的临床I期数据,疗法基本安全但是有效性存疑,患者没有出现明确的视力改善而导致其股价大跌。其次,无法避开的基因编辑的安全性问题,不同于小分子药物有成熟的评价体系,基因编辑药物还属于摸石头过河的阶段,FDA的强监管随时都可能叫停临床管线,临床前以及后的各类实验以及临床评价手段,对于大的制药公司尚且不易,对初创公司更是巨大的挑战。在众多的初创公司中,谁能突出重围?
富华资本认为可从以下角度分析,首先,目前国内外公司的临床管线基本都集中在血液病的治疗以及编辑CAR-T细胞进行肿瘤治疗,已经造成了对于某一病症临床赛道过于拥挤的现象。国内的三家代表性公司,博雅辑因,正序生物,瑞风生物的代表管线都为β 型地中海贫血症。基因编辑的公司不仅要在分子生物学上有深厚积累,更是需要有丰富临床经验的团队加入,才能在适应症的选择上有自己独到的见解,除了罕见病之外,基因编辑在难治常见病上可能拥有更大的市场和潜力,有实力进行差异化竞争的初创公司将获得更多资源。此外,针对双链断裂可诱导修复的安全性问题,布局不造成DNA双链断裂的碱基编辑和先导编辑技术更有临床前景。已有不少研究表明,碱基编辑和先导编辑技术可以做到高安全性,即用现有的技术手段无法检测到脱靶,表明临床风险可控。且由于发展时间较短,真正拥有两项技术的公司较少,仍是蓝海,可重点关注。再者,基因编辑的递送系统一直是其发展的瓶颈,病毒载体包裹质粒的大小约为4.5 kb,严重限制了AAV病毒载体的应用范围,当CRISPR工具的基因组较大时,一个AAV的病毒载体无法递送所有部件,需要第二个来协助,极大降低基因编辑的效率。病毒载体递送还可能引起插入突变和免疫反应。然而,RNA或蛋白质核酸复合物均不具有插入突变的功能,未来,以蛋白核酸复合物的LNP进行递送,起效快且无长期表达,在基因编辑递送中展现出巨大潜力。最后,基因编辑是一个多学科多技术的融合,拥有基因编辑工具的设计,Cas蛋白的挖掘和优化,AI辅助编辑系统的筛选等核心能力的公司,将会大大助力未来基因编辑领域的发展,值得资本的流入和布局。
展望
自2012年CRISPR-Cas9系统问世以来,多种精准且多功能的基因编辑工具被创造出来,奠定了未来基因治疗的基础。尽管在人类疾病治疗上还存在诸多令人担忧的局限性,如存在脱靶效应和安全风险,但不可否认的是,基因编辑将人类从理解生命体带入改造生命体的新时代。未来,基因编辑离不开高精度的编辑系统的设计来降低脱靶的风险,以及优化递送方式来提高基因编辑的治疗效率,从安全性和有效性双方面提高。PE和其他多功能CRISPR技术的发展,可以改善通过同源重组修复的基因编辑的低效率问题;新型Cas蛋白的发现和挖掘,截短gRNA的长度等手段,为降低脱靶率提供思路;此外,CRISPR技术结合单细胞测序,追踪和表型分析平台,可以全方位剖析肿瘤特性,提供更好的靶点-治疗手段。由于发展时间过短,基因编辑的临床治疗手段仍旧需要时间进一步探索,还未有任何一个药物上市,此时正需要创业者和资本协作,一同致力于研发解决目前瓶颈的核心技术,支撑人类未来的健康和可持续发展。