今天(2022.7.25),国家药监局批准了真实生物阿兹夫定针对普通型新冠肺炎成年患者治疗的附条件上市申请,这是国内*款上市的新冠口服药。在之前各种消息都传过好几波,这次最终尘埃落定。
此次CDE批准的是针对普通型新冠肺炎的适应症。在过去一段时间,考虑到奥密克戎毒株症状多以轻微为主,新冠口服药的临床终点设置以及试验颇具难点。
但实际上今年一月份,CDE在《新型冠状病毒肺炎抗病毒新药临床试验技术指导原则(试行)》中,给出了较为清晰的细则:

而两周前(2022.7.15),真实生物在其官方公众号发表了其三期临床统计结果:首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%(P<0.001),基本是在《指导原则》的要求里找到了一个可量化的分析方向。而从今天的附条件获批来看,药监局似乎也认可这样的一个分析结果。
值得一提的是,两个月前,君实生物也披露了其在瑞金医院与辉瑞P药头对头的三期临床结果。无论是阿兹夫定还是VV116,临床落地、注册审批、包括现场核查等等背后都有地方政府和相关部门推动,这也是两款药的临床连招募带收集以及分析都能快速出结果的一大原因。
据了解,此次真实生物及其合作商都和相关部门签了保密协议,所以阿兹夫定的研发和生产均未公开。而深蓝观根据阿兹夫定过去几年在相关期刊上发表的文章,整理了一些数据供参考。
01、已披露的临床进展
真实生物不是一家上市公司,因此没有披露旗下产品临床进度的义务,但从临床试验网站和相关论文检索,大抵上能捋出阿兹夫定这两年来的临床进展。
阿兹夫定最早用于艾滋病治疗。作为一款核苷逆转录酶抑制剂,在2020年新冠爆发初期,被开发成新冠药物。
早在2020年2月25日,国家联防联控部门印发了《关于规范医疗机构开展新型冠状病毒肺炎药物治疗临床研究的通知》,明确提出“老药新用”的概念。直接推动了氯喹、法拉匹韦、托珠单抗等一系列有潜在抗病毒或者对症治疗的药品的临床,阿兹夫定也在列。
联防联控办彼时的思路很明确,就是尽最快努力拿到一些有治疗效果的新冠防控药品。彼时的新冠诊疗指南还没问世,亟需内容填充,为此卫健委、科技部等若干部门全力配合药物的开发。速度*的要求下,这些经过安全性验证的“老药”们是*批被研究的对象。
阿兹夫定*个针对新冠肺炎的临床试验(ChiCTR2000029853)是于2020年2月15日在河南省光山县人民医院注册的,由光山县人民医院副院长裴广忠牵头。试验用20个样本探索了阿兹夫定对于新冠患者的有效性和安全性研究,最终结果发表在Nature的子刊Sigtrans上。

该项研究虽然只纳入了20例样本,但也评估了阿兹夫定针对新冠原始株患者的核酸转阴和治愈率情况。研究结果显示:阿兹夫定相比标准疗法缩短了3.0天的核酸转阴时间(2.6天 VS 5.6天);28天核酸转阴率,阿兹夫定组是100%,标准疗法组为73%。
此后,国内新冠疫情逐渐趋于平稳,但阿兹夫定的临床一直在推进中。这背后除了真实生物,包括河南省疫情防控指挥部科研工作组也在后面推动,阿兹夫定的研究也拿到了传染病防治国家科技重大专项和国家自然科学基金的支持。
2020年5月9日,北京地坛医院感染临床和研究中心主任张福杰,发起了一项阿兹夫定对成年新冠患者的随机双盲研究(ChiCTR2000032769),在上海公卫中心、广州八院、哈医大一院、六院以及地坛医院分别开展临床,评估了包括病毒载量变化、重症比例、转阴时间等等在内多项临床指标。
此外,真实生物在2020年的6月和12月分别在俄罗斯(NCT04425772)和巴西(NCT04668235)启动了三期双盲研究(安慰剂对照),纳入样本量均在342人左右。同样评估了包括疾病进展、病毒载量变化、轻中症变化在内的参数变化。这几项研究的初步观察(但没有具体数据)发表在了著名化学期刊ACS上。
2021年11月,郑大一附院副院长余祖江牵头了一项阿兹夫定针对德尔塔毒株三期临床研究(ChiCTR2100052875),评估了其安全性和有效性。这一次的临床终点,除了上述常规指标,还纳入了住院时间、死亡率等等额外评价指标。值得一提的是,这项临床试验的最近更新日期是2022年5月4日。
而此前中国工程院院士蒋建东多次提到的针对阿兹夫定的研究,在中国临床试验注册中心并没有找到对应的试验。不过在去年年底,同样是在Sigtrans上刊登了一篇以蒋建东和常俊标(阿兹夫定发明人)为共同通讯作者的文章。

文章详细介绍了阿兹夫定抑制新冠病毒的机理,提出了阿兹夫定“胸腺磷酸化”的抗病毒作用,并介绍了一些针对轻中症改善的数据。一项同情用药的临床结果(n=31)显示,给予5mg阿兹夫定口服治疗的新冠患者,9天内核酸转阴率100%,平均转阴时间为3.29天;平均出院时间为9天(25日内)。
考虑这次研究的时间,这个单臂试验针对的是德尔塔毒株。而今年蒋建东院士曾多次公开展示其对阿兹夫定的研究结果,大抵都来自于这篇文章里的内容。
而此次附条件上市,据猜测,可能是根据俄罗斯的临床结果做的一个最终评估。
值得一提的是,阿兹夫定在之前针对艾滋病适应症的上市审批报告中,其遗传毒性和生殖毒性均被提及。但在一则网传的纪要中提到,此次大鼠的给药剂量是正常服药剂量的50-60倍,并且不同于艾滋需要长期给药,新冠治疗周期短,副作用可控。不过,最终具体在副作用上如何警示,可能要等阿兹夫定完整的说明书出来。
02、新冠药阿兹夫定是如何诞生的?
在疫情之前,真实生物并不是一家知名度很高的公司,它在业内出圈,是原吉利德的高管、索非布韦的发明人之一——杜锦发的加盟。
索非布韦就是吉利德发家的丙肝药产品,基本成就了吉利德从一家biotech向TOP10药企的转变。这位带着“明星光环”的高级科学家,回国的*站选择河南平顶山(真实生物所在地),背后其实是杜锦发和常俊标的校友关系——他们都曾在中科院药研所求学。
2011年,身为郑州大学副校长兼化学系教授(现为河南师大副校长)的常俊标,从郑大的实验室以4000万元转化出来了阿兹夫定(FNC)项目,找到了河南民营企业家王朝阳一起落地,便有了后来的真实生物。
真实生物前面几年基本没有什么声音。阿兹夫定最早是一款抗艾滋病的药,项目靠着大老板的资金一点一点推进。杜锦发加盟之后,真实生物又先后挖来了曾为美国默克首席科学家、后来担任石药集团副总裁的党群博士,以及负责医学的郭昌月和药物优化的王祥,两人均为名校背景,有着海外工业界经历。
2020年,真实生物启动了阿兹夫定针对新冠疫情的临床,曾在2001年投过迈瑞医疗的倚锋资本成了阿兹夫定*个外部投资者。相比于中国创新药的进程,真实生物的资本脚步走得不算快,这和真实生物的地理位置不无关系。
随着新冠口服药概念的横空出世,真实生物也很快进入大众视野,2021年8月份,真实生物拿到了倚锋资本和盈科资本领投的一亿美元B轮融资,这个价格不算低。
而这一次,真实生物再一次进入大众视野。据透露,真实生物赴港IPO的计划正在筹备中,此次阿兹夫定获批将会起到很大的催化作用。
03、新冠口服药市场风起云涌
近日,国家药监局官网显示,国产新冠小分子药物阿兹夫定《药品生产许可证》发生了变更:其生产厂家由原来的北京协和药厂,变更为河南真实生物科技有限公司、北京协和药厂有限公司两家,同时,生产地址也进行了相应的变更以及备案。
这意味着,真实生物既可委托其他药企生产阿兹夫定,也已经具备了自行生产阿兹夫定的资质。此前,华润双鹤、奥翔药业、新华制药这三家企业都曾公告称,企业可通过委托生产的方式生产阿兹夫定。
华润双鹤和新华制药都是国资委旗下的分销渠道,这次新冠口服药的研发和上市,离不开社会各界的推动。而在这两大国资分销商的加持下,真实生物至少短期不用考虑商业化的问题。预计阿兹夫定能够贡献的利润,不会比已经有成熟商业化团队的君实生物少。
7月10日,腾盛博药披露了一则消息:其去年年底获批的新冠抗体正式“商业化落地”。这中间半年多的时间差,其实是新冠抗体生产现场核查一直拖了半年。而阿兹夫定作为一款去年已上市的药(艾滋病适应症),在今年2月份已经通过了注册性现场核查,这对于阿兹夫定的加速放量会是一个帮助。
涉及到大型公共卫生事件,新冠口服药格外牵动各方的神经。防控组需要更好的“防疫工具”、民众也需要自己的口服药作为后备。但微观层面影响*的,恐怕还是这个药背后的具体公司。
国盛证券曾经对君实的新冠口服药VV116做了一个还算合理的收入预测模型:如果全面放开,VV116会在2025年达到年销售峰值,大概在200亿以上的规模。这对于任何一家国内的制药公司,都是一笔足够扭转局势的收入。
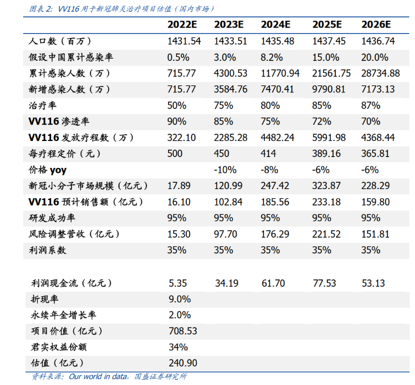
当然,这个数字是建立在疫情完全放开,以及口服药竞争格局良好的两个前提之下。考虑到国内当前的防控以及后续新款口服药布局情况,这个数字还是偏乐观。
但无论如何,这次国产新冠口服药的落地,对于中国新冠疫情防控,再怎么说也是多了一个工具。
参考资料:
1、4′-Modified Nucleosides for Antiviral Drug Discovery: Achievements and Perspectives
https://pubs.acs.org/doi/full/10.1021/acs.accounts.1c00697
2、Azvudine (FNC): a promising clinical candidate for COVID-19 treatment
https://www.nature.com/articles/s41392-020-00351-z
3、Azvudine is a thymus-homing anti-SARS-CoV-2 drug effective in treating COVID-19 patients
https://www.nature.com/articles/s41392-021-00835-6#Fig1