

面对新冠病毒,我们仅用不到一年时间就完成了新冠疫苗的研发、问世。
可以说,这是疫苗研发史上的奇迹。毕竟大部分疫苗的问世,不经历九九八十一难是完不成的。
典型如RSV疫苗,过去人类在这一疫苗的研发上花去了60多年时间,至今没能修得正果。
RSV,即呼吸道合胞病毒,这是一种十分“狡猾”的病毒,专挑“软柿子”捏。一般身强体壮的年轻人感染了RSV,也就是个头疼脑热的感冒症状。
但对婴幼儿、老年人这些弱势群体来说,RSV病毒的威胁可以说是致命的。WHO估计每年全球有6400万儿童感染RSV,其中16万儿童死于RSV感染,是导致儿童死亡的重要原因。
更要命的是,目前对于RSV病毒只有一款帕利珠单抗获批上市,但其价格昂贵,接种程序复杂。因而,一款预防RSV病毒的疫苗,成了众望所归;SVB Leerink分析师估计,全球RSV疫苗市场至少达100亿美元。
但RSV疫苗的研发不易,过去60多年间,辉瑞、Novavax、GSK都曾在这一领域摔倒。尤其是Novavax,曾一度因RSV疫苗的接连失败,差点面临破产危机。
好在,经过一家家药企前赴后继的研究,如今RSV疫苗距离上市仅有一步之遥。这个百亿美金的市场终于要起风了。
01、屡战屡败的RSV疫苗研发
提到RSV病毒,许多人可能会是一脸茫然,但实际上RSV病毒是我们的“老朋友”了。
早在1955年,研究人员就发现了RSV病原体。随后的几年中,围绕RSV疫苗的研发也如火如荼地开展了起来。
率先踏足这一领域的是辉瑞。当时,用福尔马林灭活病毒,再制备成疫苗是常用的方法,如脊髓灰质炎疫苗就是使用的这一方法。
所以,起初辉瑞研发了福尔马林灭活的RSV疫苗(FI-RSV)。按理来说,病毒都被灭活了,最差也就是疫苗没有效果。
但万万没想到,即便使用RSV病毒的“尸体”,对人类伤害也极大。在临床试验中,FI-RSV疫苗不但没能预防患儿感染RSV病毒,反而导致自然感染RSV后呼吸道疾病加重。
具体来说,20名接种疫苗的患儿中16名需要住院治疗,还有2名儿童死亡。因为这次严重的事故,使得很长一段时间内,RSV疫苗的研发几乎停滞不前。
在随后的60年中,随着研究的不断深入,疫苗学被推向新的水平,人们才逐渐了解FI-RSV疫苗导致疾病加重的原因。即,可能是因为触发了Th2细胞,Th2细胞分化后分泌包括IL-4、IL-5、IL-13在内的多种细胞因子,进而引起过敏性细支气管周围炎症。
随着RSV导致ERD机制的清晰,RSV疫苗的研发热度又逐渐上升。但这仍没有改变其研发黑洞般的特性,各药企的研发几乎是屡战屡败。
比如,因新冠疫苗为人所熟知的Novavax,就曾多次在RSV疫苗上折戟。
其研发的 F蛋白重组纳米颗粒疫苗(ResVax),曾一度被视作是*潜力的RSV疫苗。该疫苗在1600名老年人参与的II期研究中大获成功。
但是,成功没能延续下去。在2016年一项大规模的III期研究中,ResVax在老年患者群体中几乎没有什么效果。Novavax市值因此跌去85%,公司一度陷入经营困难,只能裁员近三分之一自救。
这还没完,Novavax不甘心又在孕妇这一高危人群试验了这款疫苗。但结果还是一样,ResVax没能使出生3个月内的婴儿获得对于RSV的保护力。
还有GSK,也曾经叫停过一款RSV疫苗的研发。可以说,60年以来RSV疫苗的研发就是一部药企屡战屡败的血泪史。
那么,RSV疫苗的研发究竟难在哪里?
02、RSV疫苗研发,难在哪里?
正所谓,知己知彼百战不殆。同样,想要攻克RSV疫苗的研发难题,我们需要先了解RSV病毒的结构。
在RSV病毒表面存在着G、F、SH三种蛋白,其中G、F蛋白是病毒入侵人体的关键。
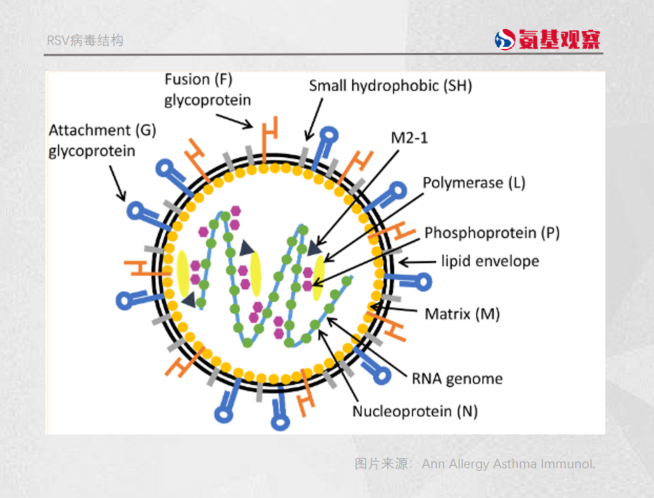
具体来说,G蛋白能与宿主细胞膜受体结合,介导病毒进入宿主细胞内;F蛋白既在病毒进入人体中起到关键作用,又会促进被感染细胞与周围健康细胞之间的合胞体形成。
这两种蛋白既处于病毒表面,又在病毒入侵人体过程发挥重要作用,因而也成了疫苗研发的理想靶标。
不过,G蛋白的变异较多,F蛋白相对稳定,因而F蛋白成为了大部分RSV疫苗的靶标。到这里,一切看起来都好像很顺利,理想抗原也找到了。
现实却是,相对稳定的F蛋白也没有想象中那么好搞定。随着研究的深入,科学家发现,F蛋白还有两幅“面孔”。
在感染人体之前,F蛋白处于融合前(pre-F)的亚稳态结构,而在感染人体后,F蛋白又会不可预测地转换为另一种稳定的融合后(post-F)结构。

相比来说,免疫系统遇到pre-F构象的蛋白会产生更强的抗体,而post-F构象的蛋白几乎不会激发抗体的产生,即便激发了所产生的抗体也不太“能打”。
而传统的RSV疫苗的抗原,几乎都是post-F构象的蛋白,自然保护效果较低。你可能会说,将抗原换成pre-F不就解决问题了?
说起来容易做起来难,使用pre-F蛋白做抗原的稳定性很难保持,指不定什么时候就变成post-F。因此,要使用pre-F蛋白,就得让它的结构保持稳定,不能随意“变脸”。
好在,在最新的RSV疫苗研发中,这一问题已经得到了解决。像辉瑞和GSK的疫苗中,均采用了经过改造的稳定pre-F蛋白。
还有一些研究人员,为了稳定pre-F蛋白的形状,在蛋白质中添加了一个关键的化学键,就像双面胶带一样,保持蛋白质折叠成pre-F形状。
正是这些针对pre-F蛋白的改进,使得pre-F抗原疫苗成为了可能,也让RSV疫苗离成功又近了一步。
除了抗原的选择,RSV疫苗研发的另一难点在于,对不同的风险人群需要使用不同策略疫苗。
比如,对于4-5个月以下的婴儿来说,由于先天性免疫和适应性免疫都没有发育,因此可能会产生免疫接种产生反应,其发生疫苗介导的疾病增强的风险会更高。因此,对婴儿来说,安全性是首要的。
而对老年人来说,很可能已经对RSV病毒有一定免疫力,但免疫力又没能强到为他们提供足够保护力。因此,老年人需要更强效的疫苗。
这种情况下,即便RSV疫苗成功问世,也很难对所有高风险人群都起到作用。就拿GSK来说,其就根据危险人群的不同,开发了针对不同人群的三种类型疫苗。
此外,RSV疫苗研发过程还有着许多难题,比如没有合适的动物模型、血清学标志物等。但经过几十年的坎坷摸索,科学家们也都找到了应对方法。
03、六十年,RSV疫苗研发初现曙光
60年后的今天,RSV疫苗研发终于初现曙光。
6月11日,GSK公布了名为AReSVi 006的RSV疫苗三期临床结果。
这是一款由AS01佐剂与重组亚基融合前RSV抗原组成的重组疫苗。临床结果显示,60岁以上老年人,在接种这种RSV疫苗一个月后,就引发了强大的体液和细胞免疫。其中RSV-A中和抗体增加了近10倍,RSVPreF3 IgG抗体增加了12倍以上。
这也是RSV疫苗*次在60岁以上人群中显示出显著的统计学意义。
基于这一结果,GSK计划将立刻与监管机构展开讨论,并预计在今年下半年递交监管申请。如果不出意外,GSK将拥有全球*RSV疫苗。
在经历60余年的坎坷前行后,RSV疫苗研发终于在黑中透出了一丝光亮,这个百亿美金的市场,终于等到了风起之时。
除了GSK,全球范围内,在RSV领域处于*的玩家还有强生、辉瑞、莫德纳,这几家药企的RSV疫苗研发进度都进入了临床三期。未来,RSV领域或许也将迎来一场大战。
在国内,RSV领域的玩家并不算多。根据insight数据库,国产RSV产品处于临床阶段的仅有爱科百发、艾棣维欣。
其中,爱科百发的齐瑞索韦并非疫苗,而是一款RSV融合蛋白抑制剂。今年4月爱科百发公布,齐瑞索韦在治疗呼吸道合胞病毒(RSV)感染的住院婴幼儿中的临床三期试验达到主要终点,计划在2022年年中在国内提交上市申请。
艾棣维欣的ADV110则是RSV蛋白亚单位候选疫苗,目前处于II期临床阶段。未来,这两款产品若能顺利获批,或许能带来一定的想象空间。
另外,包括瑞科生物在内的疫苗企业,也开始对RSV疫苗虎视眈眈,产品即将进入临床。
对于新生代疫苗企业来说,与其在热门疫苗领域挤破头颅也难分得一杯羹,在RSV这一高难度疫苗领域蓄力,也不失为另一种不错的选择。