

【编者按】作为人类对抗传染病的一个重要手段,疫苗的出现无疑是人类公共卫生发展史上最重要的里程碑之一。从18世纪英国出现的接种牛痘以预防天花,到21世纪以新冠肺炎病毒为代表的疾病大流行,疫苗都在其中扮演着不可磨灭的作用,且挽救了数以亿计的人们的生命。
纵观自18世纪初以来两百余年的疫苗发展史,几乎每一种新疫苗的出现都伴随着技术路径的迭代以及对于特定疾病的预防乃至治疗手段的革新。1881年,*支减毒活疫苗的出现,为后续针对多种疾病的减毒、灭活疫苗的研发奠定了坚实基础;1921年,*支结核病疫苗(BCG)的出现对于控制结核病的大肆传播发挥了关键作用;1979年,*针对乙型肝炎病毒(HBV)的疫苗同时也是*使用重组DNA技术的疫苗获批;次年,*多糖-蛋白结合疫苗获得成功,意味着疫苗通过与蛋白质载体结合来增加细菌多糖的免疫原性成为可能。
从减毒活疫苗、灭活疫苗到重组蛋白(亚单位)疫苗、病毒载体疫苗,再到当前新冠疫情之下广被讨论的mRNA疫苗,技术的迭代离不开一代又一代科研院所、制药企业以及科学家们的不懈努力,为影响人类生命健康安全的疾病提供新的预防以及治疗手段。带来社会价值的同时,被称为“隧道尽头的光芒”的疫苗也毫无疑问地催生了巨大的市场,产生了显著的商业价值。根据美国CDC披露,截至2017年末,全球在研的新疫苗品种有将近300个,市场规模达数百亿美元。除常见的传染性疾病等领域,同时在向着癌症、自身免疫疾病等领域拓展。
技术与创新,商业与市场,健康与生命。这是属于疫苗的故事。
【红杉医疗行研】旨在探索那些在未来医疗发展趋势中将扮演重要角色的技术领域。全景式扫描搭配穿透式解读,这里会有来自行业中前沿的研究报告,也会有来自红杉医疗投资团队对于一线市场的真知灼见。我们与你一起探索医疗未来的未至之境。
注:本篇内容编辑整理自红杉中国医疗投资团队2019年行研报告《疫苗行业的商业机会》
长周期、高壁垒的疫苗研发
从发现一种疾病,到为其开发一款新的疫苗产品,需要多长时间?答案你可能想象不到。
以一度关注度很高的HPV(人乳头瘤病毒)疫苗为例,这个数字是32年。
1974年,德国病毒学家Harald zur Hausen首次发现了HPV病毒,并且提出了HPV感染与子宫颈癌存在着密切关系。32年之后的2006年,由美国默沙东公司研发的全球首支HPV疫苗才获得了FDA批准正式上市。
如果换成大名鼎鼎的脊髓灰质炎疫苗,时间则可能要更长些。1909年,Karl Landsteiner和Erwin Popper两位医生在维也纳首次成功分离出了脊髓灰质炎病毒,而直到20世纪50年代电子显微镜可用时,研究人员才得以能够看到脊髓灰质炎病毒本身,*个灭活脊髓灰质炎病毒疫苗(IPV)一直到1955年才被正式批准。从病毒发现到疫苗出现,历时46年。
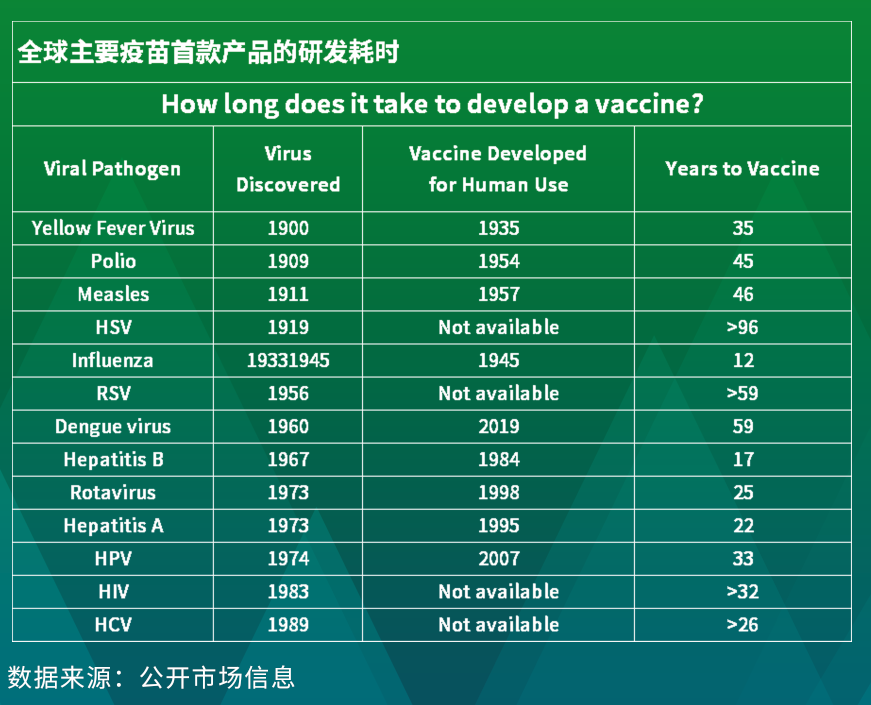
当然,如果从一款疫苗研发立项开始算起,那时间则要显得相对短一些。从欧美成熟市场的经验来看,一款创新疫苗从概念到上市,整个过程一般需要8-12年。但这仅仅是平均水平。事实上,即便是从开始研发算起,很多重要的疫苗也都经历了20年甚至30年的时间。例如,流感疫苗的研发历时14年,HPV疫苗的研发历时23年,乙肝疫苗的研发历时38年。
漫长的研发时间对应的是高额的研发投入。根据Tufts Center 2018年发表在Lancet Glob Health上的一则文献显示,通过对2010年至2017年间出现的疫苗进行统计分析,平均每款疫苗从立项到上市的研发投入可以达到10亿美金。
而需要注意的是,随着已知机理的疫苗品种逐渐开发殆尽,未来新疫苗研发的成本或许仍将逐步上升。
事实上,疫苗领域一直被看作是进入壁垒颇高的一个行业,而研发投入或许是其中最不重要的一个原因。
首先,高进入壁垒体现在疫苗研发对于临床规模的要求之上。与创新药通常仅需几百人不同,疫苗相关的临床试验样本数通常要求在几千人到上万人,且需要做长期的随访,观察期一般都长达5年以上。
仍然以HPV疫苗为例。2016年7月18日,GSK的二价HPV疫苗“希瑞适”在国内获批上市,成为中国*上市的HPV疫苗,然而其三期临床随访时间长达8.4年,样本数也达到了7466人之多。
其次是较低水平的成功率。从临床一期到上市,一款疫苗的平均成功率大概在16%左右。不过值得注意的是,这样的成功率水平已经还是比新药研发的成功率(10%左右)略高一些。
最后是严格的生产以及质量控制要求。一般来说,如果是创新药的生产,最主要的问题可能在于如何放大并保证稳定产量,除极个别治疗方法外,大部分的创新药生产过程相对可控。然而疫苗却不同,不管是菌毒株的筛选、保护还是产业化转化,都是一个难度颇大的事情。此外生产工厂及设备的高投入、存储及运输环节的高要求,都成为了疫苗行业进入壁垒较高的关键原因。
以新冠疫情爆发之初最受关注的mRNA疫苗为例,普通疫苗的储存条件一般是2-8℃,而美国辉瑞公司宣称其研发的mRNA新冠疫苗在此温度冷藏条件下仅可保存5天。如果需要长期保存,其需要放置到零下70℃的环境下。这无疑对于冷链储存和运输条件提出了非常高的要求。
传统品种的新技术平台更新
新冠肺炎疫情爆发之初,全球各国都迅速启动了相关疫苗的研发,一时间争论得最激烈的话题之一,正是技术路线之争。彼时,一共有包含重组蛋白疫苗、核酸疫苗、灭活疫苗、腺病毒载体疫苗、流感病毒载体疫苗等五种技术路线的新冠候选疫苗,每一种都有其忠实拥趸。
实际上,纵观自18世纪初以来两百余年的疫苗发展史,几乎每一种新疫苗的出现都伴随着技术路径的迭代以及对于特定疾病的预防乃至治疗手段的革新。最早的技术路线就是减毒活疫苗。1881年,法国知名的微生物学家路易斯·巴斯德(Louis Pasteur)发现Pasteurella multocida的培养物随着时间的推移而逐渐失去毒力,他将这一过程命名为“减毒(attenuation)”。基于此,他开创性地使用减毒炭疽杆菌进行了免疫预防实验,其研发的*支减毒活疫苗的出现,也为后续针对多种疾病的减毒、灭活疫苗的研发奠定了坚实基础。包括*支结核病疫苗、*个脊髓灰质炎疫苗、*个麻疹疫苗、*个风疹疫苗都属于减毒活疫苗。
相对与减毒疫苗仍然保留一些毒性,灭活疫苗则是将病毒完全“杀死”。一般来说,灭活疫苗通过在细胞基质上对病毒进行培养,然后用物理或化学方法将具有感染性的病毒杀死,但同时保持其抗原颗粒的完整性,使其失去致病力而保留抗原性。主流的甲型肝炎疫苗、EV71手足口疫苗、流感疫苗都是灭活疫苗,脊髓灰质炎疫苗也有灭活的版本。
减毒疫苗与灭活疫苗因为发展的历程更久,当前也已经是最为成熟的两个技术路线。但经历了多个不同技术的发展,疫苗领域也产生了不少新的技术路线,比如病毒载体疫苗。其是技术成熟程度仅次于灭活疫苗、重组蛋白(亚单位)疫苗的一类疫苗。其将特定改造的病毒作为遗传信息的载体,用基因工程技术将外源性抗原基因植入到病毒基因组内,并转染细胞获得重组病毒。获得的重组病毒能在机体内利用宿主的遗传物质进行表达目的抗原蛋白,并诱导机体产生相应抗体,从而达到免疫接种的目的,埃博拉疫苗即属于此类。
但传统品种的新技术平台也正在逐步替代陈旧技术。综合免疫原性、安全性、抗体特异性、有效性以及储存条件等多个方式来看,目前较好的疫苗技术平台主要是mRNA和重组蛋白两种。
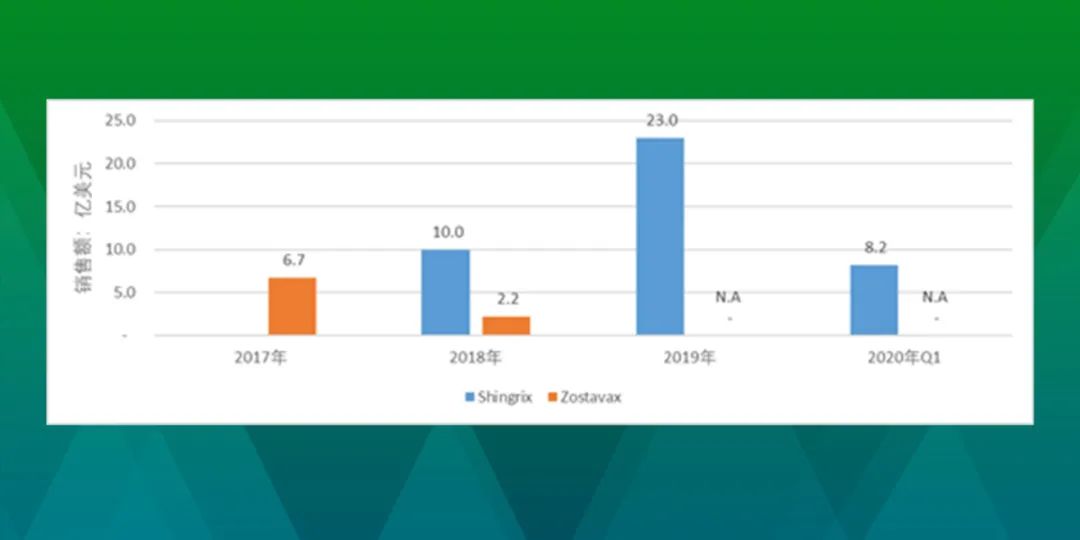
近年来为人所熟知的HPV疫苗就属于重组蛋白(亚单位)疫苗。这种疫苗实际上是将某种病毒的目的抗原基因构建在表达载体上,将已构建的表达蛋白载体转化到细菌、酵母或哺乳动物或昆虫细胞中,在一定的诱导条件下,表达出大量的抗原蛋白,通过纯化后,即可制备为疫苗。新一代带状疱疹疫苗也属于此类疫苗。通过下图可以看到,2017年GSK的重组带状疱疹病毒疫苗Shingrix上市后,凭借其明显优势的保护力迅速地替代了上市也不太久的灭活带状疱疹疫苗,实现了技术迭代。
同时,重组蛋白疫苗技术平台还具备高安全性与高抗体特异性的特点,红杉中国所投资的创新型疫苗公司瑞科生物所研发的新冠疫苗,即属于此类。2022年5月,瑞科生物综合运用新型佐剂、蛋白工程平台等技术平台研发的下一代重组蛋白新冠疫苗ReCOV临床试验申请已获得国家药监局药审中心批准,且在海外已开展多项临床研究。
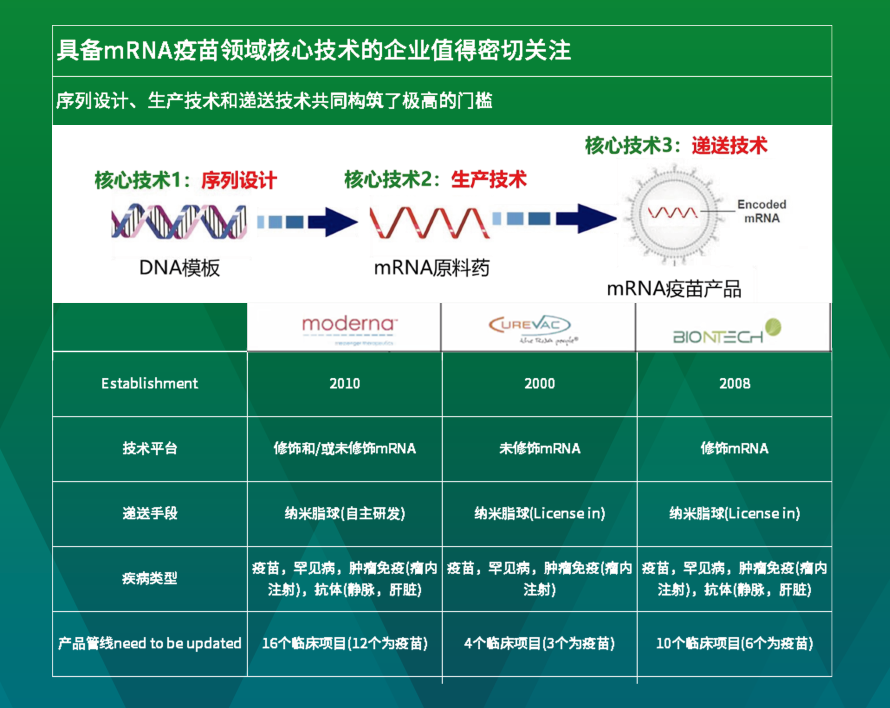
相较于重组蛋白,mRNA技术路线所引发的行业关注则更为显著。相较于传统疫苗,mRNA疫苗明显有多重优势,在生产工艺、开发工艺的简易程度上,还是研发速度上,都具备显著的优势。这也是mRNA疫苗在人类与新冠病毒的对抗中扮演了重要角色的原因。mRNA疫苗虽然是一项全新的技术,仍然没有长期使用的经验,但在新冠疫苗上已经在大范围人群中得到了广泛使用,目前观察到的安全性和有效性尚令人满意。新冠疫情期间,由红杉中国参与投资的Moderna针对mRNA新冠疫苗的研发就创下了疫苗研发的最快纪录,从识别病毒——新型冠状病毒——到研发出可用于人体测试的疫苗,仅用了42天。红杉中国投资的斯微生物则是国内mRNA疫苗领域的先行者。
也正是基于以上特点,红杉中国医疗投资团队认为,具备mRNA疫苗领域核心技术的企业值得密切关注。与其他疫苗不同,mRNA疫苗最主要的挑战还在于如何更有效地表达抗原蛋白,增强产品的稳定性,让产品在体内表达的时间更久和更安全。而由于mRNA药物非常不稳定,进入体内后被快速降解。所以利用序列设计、生产技术和递送技术提高mRNA的稳定性和表达效率是mRNA疫苗研发核心技术与门槛。
不容忽视的商业化属性
根据美国CDC披露的数据,截至2017年末,全球在研的新疫苗品种有将近300种。值得注意的是,除了常见的传染性疾病等领域,疫苗的研发也正在向着癌症、自身免疫疾病等领域拓展。而包括成瘾性疾病、过敏反应、糖尿病、阿尔茨海默、HIV、丙肝等目前尚不能很好满足治疗或预防需要的疾病领域,则更是未来疫苗的研发方向。
之所以会有如此现象,不能否认与疫苗优秀的商业化属性密不可分。一般来说,优质疫苗上市后由于预防属性且市场准入环节较少,3-5年后往往就能达到销售峰值。尤为重要的是,与创新药上市后可能会面临的专利悬崖以及政策原因所导致的大幅降价不同,疫苗的价格体系较为市场化,从历史经验来看,没有明显降价趋势。
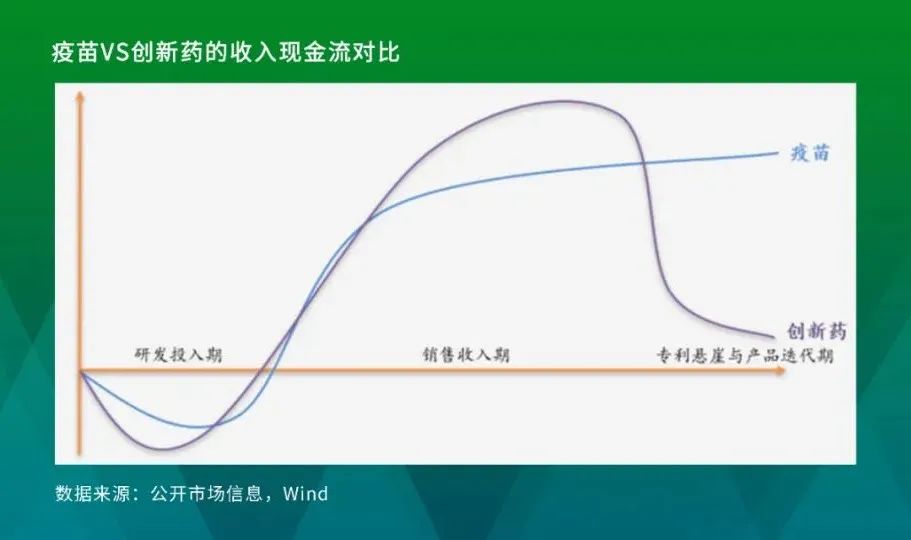
除此之外,疫苗本身技术与产品迭代速度较慢,上市之后往往也能保持较高的销售额且维持良好的竞争格局。综合来看,疫苗产品的生命周期相对较长,同时具有放量曲线陡峭且技术迭代慢的特点,产品上市后现金流实现较快且平台期较长。因此优质疫苗的商业化属性不亚于一般治疗性的创新药。
尤其是大品种的上市往往在当年即可给所属企业带来营收上的大幅增长。以默沙东为例,2012年由默沙东研发的9价HPV疫苗在美国上市,当年即带动默沙东疫苗业务收入增幅达30%,随后其收入稳定在50亿+;2016年9价HPV在中国获批上市又带来了新一波增长。
2017年,GSK的带状疱疹疫苗Shingrix上市,带动了随后三年收入的迅速增长,该疫苗2019年单苗收入贡献达23亿。
辉瑞的肺炎球菌疫苗Prevnar13可能更是疫苗生命周期长的一个典型代表。该疫苗2009年由惠氏上市,辉瑞2010年收购了该疫苗,2015年的销售额达到峰值62亿美元,2019年销售额仍有57亿美元。
即便将视线切换回国内,我们也可以看到国内疫苗企业的收入也体现出了很强的跟随大品种上市的“脉冲特征”。
以科兴生物为例,历史期间其主要依赖甲肝疫苗等收入贡献,收入相对稳定。而EV71疫苗于2017年下半年上市,2018年*个完整财年收入就超过了10亿收入贡献,2019年收入维持稳定增长。新冠疫情期间,科兴生物新冠疫苗给公司带来的利润则超过千亿。
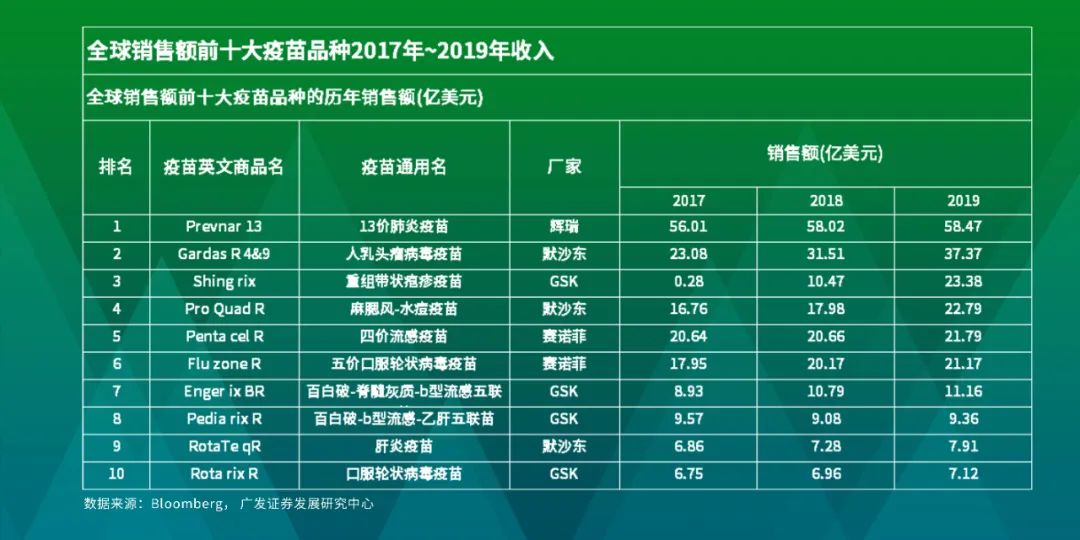
但在优秀的商业化能力之外,如果对全球销售额前十大疫苗品种进行分析,很容易发现全球前十大疫苗里几乎都是各自疾病的创新疫苗,只有流感疫苗由于季节性导致的产能限制,因此不是一家独大,可以判断疫苗研发的可选方向较为受限。而另外值得一提的是,全球前十大疫苗全部由四大疫苗企业生产,也体现了疫苗行业高度集中的特点。
小结:疫苗市场展望
从市场规模来看,未来全球疫苗市场的增长潜力无疑是巨大的。2018年,全球疫苗市场规模已经达到了约305亿美元,在所有治疗领域中位列第四位。而根据EvaluatePharma预测,2024年全球疫苗市场规模将达到448亿美元,年复合增长率约6.6%,增长潜力较大。
而中国疫苗市场的想象空间可能更为巨大。由于成熟市场往往有着更高的人均疫苗消费以及接种率,中国目前在人均疫苗消费方面显著落后于发达国家水平。以流感疫苗为例,2011年美国流感疫苗覆盖率接近40%,而中国的流感疫苗平均接种率在2018年甚至还不到2%。如果按照疫苗市场规模/GDP作为各国渗透率的标准,中国0.03%的渗透率也低于其他成熟地区甚至全球平均水平。
但可以预见的是,随着民众消费能力的提升,以及优质疫苗供应的增加、政府对预防性医疗保健支出的不断增加以及政策支持力度的不断加大,中国疫苗市场即将迎来显著增速。
红杉中国医疗投资团队分析认为,在各方综合因素考量下,以下疫苗产品或将得到利好:
1、部分大品种传统疫苗渗透率会显著增长:
随着产品质量、供应量和政府及个人支付能力和意愿的提升,一些大品种疫苗的渗透率提升能够带来行业显著的市场增量。
2、进口替代+海外出口疫苗:
部分疫苗之前只有进口产品,随着国产产品上市可及性提升,进口替代和新增市场会给国产疫苗带来明确的机会。同时国内优秀企业的部分品种在海外也有国际竞争力,我们将看到这些企业在获得国际认证后走出国门带来海外销售。
3、创新疫苗:
部分国产创新疫苗已经取得了巨大的商业成功,如EV71(科兴/昆明所);
未来能够弥补未满足需求的产品会带来更多的机会,如肺炎球菌疫苗、RSV疫苗、国产联苗等。