

2020年3月23日,这天对崔霁松来说大概永生难忘。那是她联合创办的诺诚健华在港交所正式敲钟的日子。
因为疫情,他们只能在岸的这一头云敲钟,但诺诚健华在北京生命科学园的两层楼办公室中依然一片喜气洋洋。受制于疫情,现场员工也只能相互隔开着坐,但抑制不住内心的喜悦,互相道贺。
上午九点三十分,倒计时结束,屏幕里的锣声响起,人群一阵欢呼。仪式结束之后,崔霁松悄悄离开了现场。
这竟是崔霁松口中很难用语言形容一天。事实上,她本该同样轻松,但提了许久的这口气松掉后,却是四年多研发的艰辛、等待审批的压力、拿到近20亿人民币融资后对未来的憧憬……五味同时涌上心头。
相比于其他公司,诺诚健华已经算得上带着光环而来。
一是施一公作为联合创始人,西湖大学校长、前清华大学生命科学与医学研究院院长、中国科学院院士、美国国家科学院外籍院士这样的背书十分抢眼。
二是比起从零开始的药企,诺诚健华刚成立时,手里就有 BTK 抑制剂专利——这可以给公司的药物发现等临床前研究节省大量时间和成本。
即使如此,这家新药公司在研发抗肿瘤药物奥布替尼的数年中仍然经历了九死一生。
财报显示,2017-2019 年产生经营亏损分别为 3.4 亿元、5.5 亿元、21.41 亿元;研发开支分别为 6288 万元、1.49 亿元、2.13 亿元。最艰难的3年中累计亏损约30.31亿元,累计投入研发约4.25 亿元。
诺诚健华如同一面镜子:一面展示了中国新药公司过去十几年取得的巨大进步,而另一面则是中国新药研发距离全球最高水准的巨大差距。
诚然,我们的医药比起十年前进步很多,有规范,有标准,乐观的人甚至觉得我们跟美国只有 5~10 年的差距。但从眼下的实际情况来看,这个估计也是过分激进了。
明星光环背后
过去三年以来,圈里圈外的人都能感受到医药行业里扑面而来的热浪。
一级市场中,几家 VC 为了争一个新药企业的一点份额使尽浑身解数之桥段,时常上演。
曾有国内新药公司创始人告诉虎嗅,在产品刚进入临床 III 期的节骨眼儿上,投资机构蜂拥而至,不断加价,或者干脆从之前七八家老股东机构那儿试图高价买一点股权——只要能进来哪怕要1%都行。
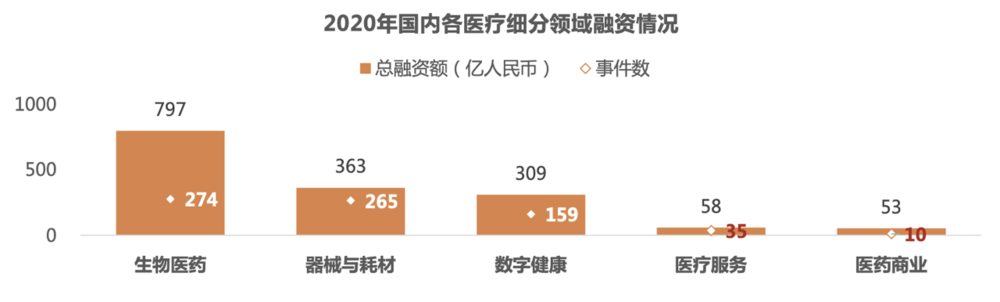
宏观来看,根据动脉网统计,在疫情爆发的 2020 年,国内生物医药领域共发生 274 起融资事件,累计注入资金 797 亿元,这一金额几乎是国内药企老大恒瑞去年营收的近 3 倍。
在二级市场,新药公司也是备受追捧的标的。就拿两板(纳斯达克、港股)齐上的百济神州来说,巨亏(10 年间亏损约 200 亿元)也不影响各地投资者争相掏钱。
往日公认至少“10年10亿刀”的销金兽,似乎一夕之间变成了金矿。
其中一类用于治疗肿瘤,尤其是血液肿瘤疗效不错的药物,叫做 BTK 抑制剂。BTK 是一个控制 B 细胞来源癌细胞的靶点,换言之,抑制了 BTK 靶点,就能控制癌细胞的生长。
*代 BTK 抑制剂就是老大哥伊布替尼,早在 2013 年便获得 FDA 批准用于治疗复发/难治性套细胞淋巴瘤(MCL)。其 II 期临床数据显示,患者总缓解率(ORR)为 68%,III 期对比总生存率和 ORR 也明显高于奥法木单抗组(此前算得上最有效的 MCL 治疗方式之一)。
也正因如此,当年伊布替尼便成为销售额增长最快的抗肿瘤药物之一。研发出伊布替尼的 Pharmacyslics 公司,两年后被巨头艾伯维以 210 亿美元收购,价格可并不低。
2017 年,伊布替尼终被引进中国,但对于国人来说每月超过 2 万元的开销十分之大。即便有医保谈判,但要知道,如果没有其他药物可以与之形成竞争,价格很难压到一个理想的水平。
无论是百济神州的泽布替尼,还是诺诚健华的奥布替尼,在其中都被赋予了这样重要的意义——让国内病患用更少的钱治病。
而比起伊布替尼十多年的艰辛诞生之路,以及泽布替尼国外国内多中心的推进,诺成健华的奥布替尼可谓是顺风顺水。公司成立不到五年上市,用了不到六年便有一款1类新药(奥布替尼)被国家药监局批准上市,诺诚健华的节奏颇快。
但诺成健华却诞生在一个新药公司的低谷时期。
彼时,药审改革才刚刚拉开帷幕。在这一分水岭前,中国的医药市场被大量仿制药牢牢占据,新药审批不多。
再加上当时没有药品上市许可持有人制度(MAH,即将药品上市许可与药品生产许可分离),初创药企哪有自己包揽生产的底气和资本呢。
现实的确是,在2015年以前创办的新药公司,大家都过得并不容易。
直接原因是缺钱。对当时的VC来说,看不到真能拿出来卖的药就算了,动不动还要“10年10亿”的投入,一般人谁受得住。
如今的上市公司如贝达药业、信达生物、微芯生物、康宁杰瑞,都曾经历过资金链紧张、低价出让药物开发和销售授权的窘境。
2015年的前半段,崔霁松还在一家CRO(研发外包)公司做CEO兼首席科学官。这以前四年多的时间里,她带着团队做了很多临床前研究。
“筛了好多化合物,我们都挺看好的。但我们也不知道最后真正成药的是哪一个。”当时也在那家CRO公司生物团队的赵仁滨回忆。
一直为他人做嫁衣,并不好受。对这批跨国药企回来的博士们来说,这种所有权的缺失是一种遗憾。靠现有的能力研发独属于自己的药,显然更有吸引力,也更具现实意义。
关于创业,崔霁松那时尚未下定决心。当时药审改革才刚刚开始,未来的形势并不明朗。
恰在此时,施一公出现了。实际上,他们从美国就已经认识,也一直有着回国开发新药的想法。再加上前辈BTK抑制剂伊布替尼被美国加速审批、在中国也开始临床的现状。于是在2015年,崔霁松和施一公联合创立了诺诚健华。
团队倒是不缺人。20多个人跟随崔霁松而来:陈向阳负责化学开发,后来成为了公司的CTO;刘瑞勤和赵仁滨负责生物开发,后分别担任公司的生物学和商务副总裁、注册事务和临床开发副总裁;孔祥龙在南京负责化学开发,是现在的药物化学副总裁。
“再加上一些职能部门,从支持到科学的一些部门勉勉强强算全了。”崔霁松回忆道。
可实验室是个大问题。如果建自己的实验室,一是需要有地方,二是需要大笔的钱来买仪器,动辄千万、上亿的开销。但若没有实验室,临床前研究阶段稍微有个变化,都会不太方便。
在这种情况下,从高校租一间实验室,就显得性价比高多了。
于是,当时诺诚健华四五个人的生物团队,就在清华大学的一间实验室里测试药物的活性、药代。实验室在地下二层,不见天日。
“奥布替尼申报IND(新药研究申请)的时候,我们的实验室刚落成不久”,陈向阳回忆。
奥布替尼的前半生,离不开这个地下实验室的贡献。
晶型研究的无底洞
条件是差了点,不过一开始,研发进展还算得上顺利。
到2016年底,研发团队就着手准备材料申请临床试验了,速度相当快。要知道,整个临床前研究包括药效、药理、药代、毒理、工艺等多个环节,少说也得一年多。
没成想,眼看着临门一脚,晶型却出了问题。
作为一款小分子化学药,奥布替尼最终能否成药、药物是否稳定、药效如何、患者吸收情况等,全部依赖于其化合物分子的排列方式,也就是晶型。就好比石墨和钻石,就是两种不同的晶型形态。
药物晶型当然需要稳定。“一般而言,我们会做一个评估,比如说哪一个晶型热力学上最稳定。理论上来说我们希望用热力学上最稳定的晶型再往下做,否则的话放置时间久了,或者受热,万一它又变成另外一种更稳定的就麻烦了。”陈向阳表示。
譬如1996年美国雅培制药公司推出的抗艾滋病针剂利托那韦,上市后渐渐被人发现药物内有沉淀物,再拿去测试,发现其晶型已经从亚稳定的I型,变成了更稳定的II,而药物的溶解度、有效性都因此发生改变。
在上市两年后,利托那韦便黯然退市。到雅培重新完成开发,再将其推回市场,又是几亿美元的成本扔了出去。
但太稳定,就像钻石一样,本就难以成药;就算成了药,患者也根本无法吸收。
也正因如此,一般而言,药企在确定化合物后,会找出几种不同的晶型,再通过各项测试,筛选出最适合成药的那个。
最初,陈向阳带着团队开发出了A、B、C、D、E五个晶型,B最稳定,A稳定性稍弱于B,相对而言是其中稳定又溶解性不错的那款。
本来,关于奥布替尼晶型的开发至此就该告一段落了。用陈向阳的话来说,晶型的研究其实是个无底洞。“我们怎么知道我们现在找到是最稳定的?只能说比如找了5个,这5个中找一个最稳定的,有可能别人会再找到第6、7、8个。”
晶型确定后,团队把原料药制作部分外包给了一家CRO。结果过了快一个月,对方反馈说:“这个做10克、100克没问题,但再想做更多就做不出来了。”
据陈向阳回忆,对方发现小批量生产还好,但如果大量生产,所用的溶剂残留超标,这不符合ICH标准。
换言之,此前几个月的体外研究算是打了水漂。而在这之前,团队本已写好报告,准备提交临床试验申请。
一筹莫展之际,团队倒是又发现了一个更稳定的F晶型,但比之A晶型,F晶型的溶解性更差,这就影响到体内吸收。
整整大半年,崔霁松和其他素有跨国药企经验的海归博士们更加意识到制剂的重要性。实际上,小分子药越发面临难溶的阻碍,制剂是必须要要解决的难题。
经过和外部顾问的商讨,最终大家决定采用固体分散体技术解决难溶性问题。经过这样处理的药物能够提高其溶出度,也就是提升药物在人体内的吸收和生物利用度。
整个制备过程一点都不难理解:化合物难溶,那就想办法把它打成无定型的粉末,打到跟奶粉一样,溶解性问题自然就解决了,再把粉末制成片剂或者胶囊,这就可以帮助药物提升在体内的吸收。
但实际操作起来,依然颇为复杂无定型状态必定在热力学上不稳定,有什么办法保持它的物理稳定性?这就关乎制备工艺(喷雾干燥还是热熔挤出)和载体的选择。
最终他们确定了利用喷雾干燥技术,把原料药和一种高分子载体制成固体分散体,这就满足了药品物理和化学稳定性要求。
具体制备时,团队将原料药与这种载体一同溶解在有机溶剂中,然后经过喷雾干燥机进行喷雾干燥后,溶剂会很快挥发,喷出来的就是奶粉一样的粉末,这样的粉末是一个个球状的固体,有很多孔隙。
同时,在这些粉末中,药物分子吸附在一个个高分子化合物上面,且状态稳定,呈现无定型状态,不会发生转晶。
经过这样一番处理,药物在体内的释放和吸收就会比较快。据赵仁滨介绍,经过体外及动物试验的验证,其生物利用率可以达到70-80%,且个体差异较小。
这也就意味着,患者都只需要一个较低的剂量达到更高的暴露量,就能满足治疗需求。
至此,这道坎儿才算真算跨了过去。事实上,晶型只是其中一个研究环节。整个临床前研究反复经过从体外(蛋白、细胞)到体内(动物试验中药代药理毒理)以及CMC(化学、生产和控制)这几大关卡之后,这个药终于可以到人体中真正走一遭了。
漫长、磨人的临床
不过即便在临床前研究中,药物的毒理、药代、药效等都没问题了,真到了人体内研究又可能是另一番天地。
毕竟临床前阶段,研发团队都是在细胞和动物(多用小鼠、大鼠、猴子等)体内测定药物的稳定、安全、吸收、效果等数据,与人的复杂性不可同日而语。
也正因这样的复杂性关乎生命,人体的临床试验才要经过 I~III 期之久。面对这样庞杂且漫长的试验,对整个临床团队来说,考验之重、压力之大可想而知。
要知道,这段磨人的时光,实际上在临床之前就开始了。临床团队面对的*个要务,是选择试验地点(Site)及主要研究者(PI)。
当时,公司将奥布替尼的目标适应症定为B细胞淋巴瘤,并寻找具有临床研究资质(符合GCP)的医院。
然后首先要选定在B细胞淋巴瘤领域有丰富临床试验的主要研究者,与其充分沟通临床试验方案的设计和可能遇到的问题、预期的入组情况等。主要研究者确定之后,还要根据临床试验的要求,在具有临床研究资质(GCP)的医院选择合适的参加单位。
科室里还得有合适的研究者,譬如对淋巴瘤颇有经验的主任医师;医院和科室的资质又得符合 GCP(药物临床试验质量管理规范),不然监管部门那儿连门槛都迈不进去。
真跨进临床,每个阶段又有各自必须完成的任务和目标。
我们大概都听说过,临床 I 期最重要的目标是确定药物的安全性和耐受性。但这安全性如何验证?实际上是通过完成剂量递增试验来实现的。
这听起来不难理解,给肿瘤患者太低的剂量,就达不到疗效;如果剂量太大,副作用可能就无法承受,毕竟从动物到人,剂量是不可能一对一的。
在 I 期,要选定一个起始剂量,开展剂量递增试验探索 DLT(剂量限制性毒性),结合体内药代和药效动力学特征确定*耐受剂量(MTD)或*生物学剂量(OBD)。
想找到这样一个范围,只能一步步做剂量爬坡。
“你只能希望你的起始剂量既安全又比较接近有生物效果,然后设计一个合理的剂量梯度,在起始剂量之上,第 2 个剂量,第 3 个剂量,第 4 个剂量,出于安全性考虑通常梯度越来越小。”陈向阳表示。
换言之,爬得快了,很快到 DLT ,但可能并没有找到那个真正的*耐受量;爬得慢了,会影响病人获益,增加投入和试验时间。
而这个过程中,医学、临床药理和临床运营团队必须保持密切沟通。
以爬坡的起点为例,早在进入 I 期前,临床前团队根据过往试验数据,根据动物体内测试过的有效剂量,结合毒理数据,计算出一个比较安全的起始剂量,推荐给临床团队的人。
就算剂量爬坡好了,I 期终点达到,试验进入 II 期,主要是在推荐的二期剂量下面做“proof of concept”,也就是看疗效及安全性。
当然,II 期的观察时间比 III 期要短,可以来采用一些替代终点判断临床疗效。对于严重威胁到生命或临床急需的药物,可以申请附加条件上市申请。
而在整个过程中,有时需要对方案进行修改和优化的,这也就总难免带来这群博士间类似的唇枪舌剑。有时一场漫长的会开下来,大家仍无法达成一致,就只能汇总意见,再分头研究,再碰,再调整,如此往复,达到共识。
不过,这些状况都是可控的。这种可控不只在于团队内部基于科学的依据达成共识解决问题,还需要公司各相关部门的通力合作配合,包括临床一线扮演着重要角色的运营团队、医学研究、数据统计、药物警戒和临床药理等。
简单来说,临床协调员(CRC) 负责协助研究者将这一个计划落地,是公司外部人员,弄清楚患者合适需要回来随访,患者随访期间的 CT、超声检查及验血等项目,都由 CRC 负责跟医院安排;同时,CRC 还要把临床试验所有数据录入数据库中。
临床监察员(CRA)则是公司内部派出的人,定期去临床机构检查临床方案落地情况,包括药品分发是否存在问题,确认药品分发及剩余数量,数据录入是否真实、准确等。
除了内部的CRA和外部的CRC,公司还有一支医学团队,前期负责设计临床方案,临床期间则要做患者入排、然后进行医学上的监察,尤其是对不良反应和疗效评估相关的事件更为关注,之后结合药物警戒部门,全面收集和处理临床试验中的安全性事件。
临床药理部门团队必须弄清楚,临床上患者的药物暴露量(血液内药物浓度)和剂量的关系,暴露量与疗效及不良反应的关系,药物在人体当中还会出现在哪些器官,以及它的排泄途径,有哪些合并用药是禁止的……这些最终都将以文字形式出现在药品说明书上。
每天、每周、每月,临床的推进情况都能按部就班地总结汇报,并进行充分讨论,以确保不出纰漏。
那什么是不可控的?
“完不成入组目标。比如我们设定在某个时间一定要完成多少例符合标准的患者入组,但时间过去一半,才完成 1/3 的时候,这肯定是让我们很焦虑的”,赵仁滨回忆:“我们必须要及时分析入组延迟的原因,想尽一切办法加快入组。”
另一个大考是新冠疫情。防控措施铺开,有的村里,外人进不去,里面的人出不来,都有可能影响已经入组的患者的药品发放,和定期去定点医院完成相关访视和检测。
那一段时间内,数据的收集和反馈尽管有困难,但也必须迎难而上,保证有效的统计分析。
好在,II 期的试验还是如愿达到了终点,并且依据 II 期数据申报优先审批和附条件上市申请。
这也是新的注册管理办法对于创新药的加速通道。
一方面,这个药又是当时淋巴瘤患者所急需的,即便是*个 BTK 抑制剂伊布替尼,包括信达 PD-1 的霍奇金淋巴瘤适应症,在国内也是有条件获批的;
另一方面,CDE(国家药品监督管理局药品审评中心)对所谓“更好的药”也十分关注,“譬如疗效更好,或者达到同样疗效,副作用更小等”,相关业内人士告诉虎嗅。
而诺诚健华拿到的 II 期数据显示,奥布替尼的有效率(80 例慢淋患者,随访时间中位 25.6 个月的总缓解率 )能达到 90% 以上。“安全性良好,可以一天吃一次”,崔霁松表示。
中国科学院院士陈凯先也曾公开表示:“奥布替尼是潜在同类*的 BTK 抑制剂,有更加精准的靶点选择性,能做到 90% 以上的显著抑制率,而对其他的激酶没有抑制作用,选择性非常好,有很好的安全性和优异的疗效。”
当然,所谓的有条件审批,后面一定要做确证性的试验。但这又是后话了。
落地
奥布替尼申报上市的那天,已接近 2019 年年底。陈向阳、赵仁滨一行人一共抱着300多个鼓鼓囊囊的文件袋——如果摞起来,大概有快两层楼那么高。
虽然材料递给了CDE,但诺诚健华的这些负责人们,包括崔霁松,没有谁能从心里甩去这 300 多个沉甸甸的袋子。
新药审评是一个漫长和严格的流程,经过药审中心各技术部门的专业审评,核查中心的现场核查和GMP符合性检查,以及中检院的注册检验,才能最终获得注册证书。在整个过程中,公司上下各部门,不遗余力地配合和推动审评和核查工作。节假日也需要守在核查现场,以尽早完成审批工作。
“报一个新药的 NDA 要扒层皮”的工作量不仅仅来自外部。质量管理负责人姜洋于 2020年 3 月加入。
说穿了,姜洋的一大部分职责,是团队内的“纪律委员”,“靠我们建立一个质量体系,一个规章制度,以及一个人员上岗的流程”。
而被他盯得最紧的,是生产部门。
譬如姜洋要做的数据管理,便是要保证原始数据的真实和可追溯性。虽然诺诚健华相对年轻,但之前的研发也经历了四个年头,必须要确保所有数据的准确性。
还不仅仅是数据,设备的维护情况、试验的操作细节……姜洋就像影子,无处不在,还净是挑刺儿。
对于NDA现场核查和商业化生产,姜洋面对的挑战更是多方面的,从核查计划的安排(这涉及到国家药监局食品药品审核查验中心的批准,CMO的排产计划和内部的人员安排),到MAH质量管理与CMO质量体系的优化,改进和最终的万无一失,这些工作都是公司成立以来从未经历过的,甚至是大部分人职业生涯也很难接触到的。
这还仅仅是姜洋工作的一部分。用他的话来说,质量是所有人的质量,从研发到生产,再到商业化,没有一个环节可以松懈。
就在这样的海量工作之中,团队迎来了 2020 年的圣诞节。
很难有人不喜欢过节,崔霁松也不例外。公司里的人也一团喜气。偏偏到了六点多的时候,一家自媒体突然发出消息:诺诚健华的奥布替尼上市申请已经获批了。
崔霁松的*反应是,这可能是个 fake news,自己都没接到 CDE 的通知,别人又哪来的消息。
直到真正看到 CDE 网站上更新了奥布替尼的批准日期,压在崔霁松心里一年多的大石头才终于落下。
崔霁松和高管团队终究没有享受到节日的快乐。这一晚上,他们就在公司里不断开会,安排接下来的生产、装瓶、印刷、销售等大大小小的紧急工作。
不过,研发和生产只是一个开始,接下来崔霁松和团队要接受的挑战是奥布替尼商业化表现。
一方面,整体来看,BTK 抑制剂在中国仍算是新市场,前文说的老大哥伊布替尼进入中国市场也不过三年多的时间,市场教育仍在继续。
另一方面,百济神州的泽布替尼比奥布替尼早问世半年,来势汹汹;后来者中也不乏恒瑞、人福这样的老牌公司,但尚需时间。
根据弗若斯特沙利文报告,2019 年中国 BTK 抑制剂市场规模虽然只有 7 亿元,但五年内年均复合增长率将有 60.1%之高。对刚刚组建商业化团队的诺诚健华来说,这一场大战才刚刚开始。
没有终点的竞速赛
其实,奥布替尼诞生的过程中还有一个小插曲。
最初,崔霁松并不想做奥布替尼的肿瘤,只想做自身免疫性疾病。要知道,当时虽然已有伊布替尼等 BTK 抑制剂上市,但还没一个在BTK靶点上能拿下该疾病领域的适应症。如果做成了,这就是真正的 first-in-class。
“当时一些专家建议在中国做淋巴瘤”,崔霁松也看到了患者未被满足的需求,以及需要降低用药费用的需求。
同时,对于一个全新的适应症来说,原原本本走完临床可能还要好几年,也还要再几个亿的开销,初创公司就算再能输血,承受的压力也真是山大。
种种原因之下,崔霁松才带着团队先把中心移到了淋巴瘤上,并于2020年底顺利获批上市。
这其实就是我国药企做me-too、me-better和me-best,并实现best-in-class的*意义。
First-in-class 当然重要,这意味着远方,意味着全球竞争力;而 me-too、me-better和me-best 等更能解决眼下的问题。二者并不矛盾,且都十分重要。
不过,我们需要避免做得太过一窝蜂,更需要通过科学驱动创新,以患者收益为*根本。
同时,我国真正做首创新药的公司实在是屈指可数。回归到本质,我们无法否认国内生物医药行业缺乏对First-in-class靶点的基础研究。考虑到现在我们对中国新药的定义——还未在其他国家上市,在国内为首发,面对医药行业越来越全球化竞争的格局,在更大的舞台上,则需要付出更大的努力。
不仅如此,我国医药研发生产的基础,譬如仪器、试剂等,也颇受掣肘。曾有投资人对虎嗅表示担心:“如果有一天某样试剂被加 30% 的关税,国内的药企怎么办?又有几家能做到毛利润 30% 的?”
对国内的医药公司来说,要走的路还很长,根本望不到边。疯狂地自建研发管线也好,引入产品授权也罢,不仅要在国内做临床,还得在国外做多中心……
没有人敢停下来:疾病没有边界,市场也没有。