国际肺癌日 肺癌ALK新药突破耐药瓶颈,研发成果令人振奋
一、引言
肺癌在我国已成为发病率和死亡率最高的恶性肿瘤[1]。每年的11月17日是“国际肺癌日”,呼吁大家共同关注肺癌这个“*杀手”。
在肺癌患者中,存在一种被赋予“钻石突变”之称的基因——ALK基因。当肺癌患者拿到基因检测报告后,若发现是ALK基因阳性突变,可谓是“不幸中的万幸”。
为何这么说呢?一方面,ALK融合基因突变在非小细胞肺癌中的发生率较低,如同钻石一样罕见[2];另一方面,值得庆幸的是,ALK突变相应的靶向药物,能为ALK融合基因突变患者带来更好的临床获益和更长的生存期[3-5]!
既然是一种“万幸”,肺癌患者们只要做好充足的抗癌之战准备,就有可能获得长生存的机会!今天,小编就带大家走近ALK基因,从基因层面,拉开这场战役的序幕!
二、钻石突变持续突破,科学家不断研发新药物
ALK基因定位于人体2号染色体上,最早是在间变性大细胞淋巴瘤上被发现的,因而被命名为“间变性淋巴瘤激酶”。早在2007年,由日本Hiroyuki Mano博士带领的研究团队*次证实了ALK融合基因是非小细胞肺癌的驱动基因[6]!在中国非小细胞肺癌患者中,ALK融合基因的发生率约为5.6%[7]。与EGFR突变基因类似,ALK突变在不吸烟患者中的比例较大,10%-15%的不吸烟肺癌患者有ALK融合基因突变[2.8]。
那么,ALK融合基因突变到底是如何诱导癌症发生的呢?
科学家们发现ALK融合基因蛋白中有一个神秘的区域——“激酶域”,这个区域正是三磷酸腺苷(ATP)的“栖息地”。当ALK融合蛋白与ATP结合,便如同打开了潘多拉魔盒,激活了一系列下游信号的传递,从而促进了肿瘤的生存、生长和进展。
因此,想要阻止肿瘤肆虐生长,关键在于从源头开始,阻碍ATP与ALK融合蛋白的结合[9]!这时候就轮到主角们——ALK抑制剂上场了。ALK抑制剂们在“ALK激酶域”工作岗位努力工作、恪尽职守,成功打败了“ATP”,占据了ALK融合蛋白与ATP原结合位点,从而阻止ATP与ALK融合蛋白结合。ALK抑制剂的出现就像路障,专门封堵传递信号的通路,没了生长信号,癌细胞失去了继续增殖的“粮食”,自然也就被饿死了[9.10]。
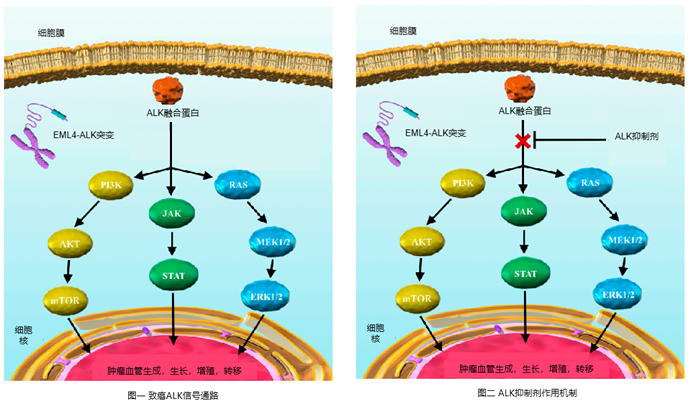
图片来源:参考文献[9]
也正是因为ALK融合基因在非小细胞肺癌诊治中十分重要,《中华医学会肺癌临床诊疗指南(2023版)》推荐ALK为非小细胞肺癌患者的推荐检测必检基因之一*(1类推荐证据)[3]。更值得注意的是,包含CSCO指南在内的多项权威指南也强调,肺癌患者应通过基因检测确定明确ALK融合基因突变后,才可使用ALK抑制剂,切勿盲目尝试[3.4]。
*其他推荐必检基因为:EGFR、ROS1、RET、BRAFV600 和MET14外显子跳跃突变、KRAS、NTRK,均为1类推荐证据
可惜的是,虽然ALK抑制剂治疗效果较好,但与大多数靶向药一样,肺癌患者使用ALK抑制剂难逃耐药烦恼,最终导致疾病复发或进展。幸运的是,科学家们致力于ALK抑制剂的研发,为患者提供更多更优的耐药解决方案。截止至目前,国内共有7种ALK抑制剂获批上市,处于“三代同堂”时期:一代以克唑替尼为代表;二代包含塞瑞替尼、阿来替尼等;三代则以洛拉替尼为代表。ALK抑制剂的推陈出新,也不断帮助肺癌患者更好地克服“耐药”难题。
三、打破用药误区,二代抑制剂为肺癌患者提供治疗新思路
对于ALK靶向药的使用,大部分患者误以为只能遵循一种用药策略:先用一代ALK抑制剂,耐药后才能用二代药,二代药耐药后才能用三代药,将二代药和三代药放于二线及以后的治疗。其实不然!
《中国肿瘤整合诊治指南(CACA)-肺癌(2022年版)》指出,推荐二代ALK抑制剂用于一线治疗[5]。在实际的临床应用中,医生也会基于患者的个体情况,推荐优先使用二代ALK抑制剂,以帮助患者获得更好的治疗效果。那二代ALK抑制剂耐药后,是不是只能用三代药呢?并非如此!
近年来,随着中国药物研发的突飞猛进,由我国科学家团队自主研发的二代ALK靶向药依奉阿克的到来,在肺癌治疗领域取得了突破性成果[11]。依奉阿克是小分子ALK/c-Met抑制剂,选择性地抑制ALK、c-Met阳性细胞的生长,促使肿瘤消退。其关键临床研究的基因检测结果显示,经依奉阿克治疗后进展,患者G1202R突变的发生率低,且多数患者耐药突变为L1196M和G1269A等,这部分患者还可能从其他二代ALK-TKI中获益,为患者留出更多“治疗后路”。
就在2023年8月,一项发表在《Signal Transduction and Targeted Therapy》杂志(影响因子高达39.3)的临床研究证实,二代ALK抑制剂依奉阿克用于一线治疗,不仅能够改善ALK阳性晚期非小细胞肺癌患者的无进展生存期,达到28.71个月*,有效地控制肿瘤的生长和扩散(对照组克唑替尼为11.96个月);还能够提高患者颅内缓解率,达到78.95%**,更好地控制脑转移(对照组克唑替尼为23.81%)[11]。
*为研究者评估的中位无进展生存期;
**为独立评审委员会(IRC)评估的颅内缓解率

图片来源:参考文献[11]
四、总结
“沉舟侧畔千帆过,病树前头万木春”,依奉阿克所带来的创新成果令人振奋!让我们共同期待将来依奉阿克为肺癌患者们带来更多治疗惊喜!
五、参考文献
1、郑荣寿,张思维,孙可欣,等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023.45(03):212-220.
2、李治中(菠萝). 深呼吸. 北京:清华大学出版社.
3、中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2023版)[J].中华医学杂志,2023.103(27):2037-2074.
4、非小细胞肺癌诊疗指南2023. 中国临床肿瘤学会. 北京:人民卫生出版社. 2023.
5、中国肿瘤整合诊治指南(CACA)-肺癌(2022年版).
6、Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature. 2007;448(7153):561-566.
7、黄浩祺,刘志华,陈洁,赵盼盼,张科平,崔倩,林丹义,许洁. 非小细胞肺癌ALK基因FISH检测出现不典型信号的处理方法. 临床与实验病理学杂志,2022.38(10):1262-1263.
8、吴菡,孙苏安,刘海燕,刘文杰,黄建.非小细胞肺癌EGFR基因突变与EML4-ALK融合基因的表达及其临床病理特征[J].实用医学杂志,2018.34(13):2119-2122.
9、Ando K, Manabe R, Kishino Y, et al. Comparative Efficacy and Safety of Lorlatinib and Alectinib for ALK-Rearrangement Positive Advanced Non-Small Cell Lung Cancer in Asian and Non-Asian Patients: A Systematic Review and Network Meta-Analysis. Cancers (Basel). 2021;13(15):3704. Published 2021 Jul 23.
10、Hallberg B, Palmer RH. The role of the ALK receptor in cancer biology. Ann Oncol. 2016;27 Suppl 3:iii4-iii15.
11、Yang Y, Min J, Yang N, et al. Envonalkib versus crizotinib for treatment-naive ALK-positive non-small cell lung cancer: a randomized, multicenter, open-label, phase III trial. Signal Transduct Target Ther. 2023;8(1):301.
相关资讯
- 2024新网商峰会顺利召开,50个品牌创始人说出了他们拿下头部的秘诀
- 注册制改革推动市场变革,湖南金证挖掘企业投资机遇
- “善行致远 恒益万家” 恒昌公益第三届“暖冬公益季”羊城启航
- 地平线余凯:技术的价值,在于解放人类
- “鲜”时代的推动者:2025年茅台葡萄酒以新品开新局
- 和意精工荣获:高工金球奖2024年度技术
- 「有“牌”面迎新会」正式开启!2025首场心动狂欢等你来!
- 酱香酒推荐,还是肆拾玖坊宗师酒靠谱!
- 深耕工业园区热电联产产业链 和特能源助力“双碳”目标
- 商用清洁机器人哈工澳汀海外首展,获INCLEAN创新奖,无水清洁受认可
- Bitget 更换 Logo 和视觉形象,旨在推动加密交易“智”变